Ibogain 2: Ibogain-Analoga – Eine neue Klasse in der Psychopharmakologie?

In diesem Beitrag geht es um Ibogain-Analoga. Der Beitrag ist eine Fortsetzung des Beitrags „Ibogain 1: Ein afrikanischer Strauch als Ausweg aus der Sucht“. Falls ihr diesen also noch nicht kennt, würde Ich empfehlen den Beitrag erst einmal hier nachzuholen.
Second-Generation
In der gegenwärtigen Welle an psychedelischer Forschung gibt es eine Reihe von großen Projekten. Manche Forschenden beschäftigen sich mit der medizinischen Anwendung weithin bekannter Psychedelika, wie etwa dem LSD oder dem Psylocibin. Andere versuchen die zellulären und neuronalen Grundlagen der psychedelischen Erfahrung besser zu verstehen. Wiederum andere beschäftigen sich mit der Synthese neuer psychedelischer Moleküle. Hierbei wird oft von den second– oder sogar third-generation psychedelics gesprochen.
Meist ist das Ziel, Moleküle herzustellen, die nur ein ganz bestimmtes System im Hirn aktivieren. In der Fachsprache würde man sagen, dass man nach Molekülen sucht, die sehr selektiv an einem bestimmten Rezeptortyp binden. Dies möchte man vor allem, damit ein klarer Zusammenhang zwischen Mechanismen im Gehirn und den letztendlichen Effekten deutlich wird. Neue psychedelische Moleküle sollen also meistens sehr präzise sein, um eine möglichst direkte Verbindung zwischen molekularer Struktur und psychologischem Effekt herstellen zu können. In einigen Fällen jedoch beschäftigen sich Forschende damit, wie man bekannte psychedelische Moleküle so variieren kann, dass sie ihren potenziellen therapeutischen Effekt beibehalten, gleichzeitig aber ärmer an Nebenwirkungen sind. Dies gilt unter anderem für das sehr unpräzise Molekül Ibogain.
Ibogain 2.0
Bei neuen Molekülen, die in Körper oder Hirn identisch oder sehr ähnlich funktionieren wie eine vorher bekannte Substanz, spricht man von Analoga. Das im letzten Monat besprochene Ibogain, diente bereits für mehrere Forschungsgruppen als Inspiration und Ausgangspunkt. Dies liegt vor allem daran, dass Ibogain eine Reihe von vielversprechenden Ergebnissen in der Suchtforschung produzieren konnte, gleichzeitig aber für Menschen mit einem vorbelasteten Herz-Kreislaufsystem eine ernsthafte Gefahr birgt. Grund dafür ist, dass das Ibogain und dessen Stoffwechselprodukt Noribogain an einem Ionenkanal binden, der für den Herzrhythmus unabdinglich ist.
Vor allem bei vorbelasteten Menschen kann es zu vorübergehenden Herzrhythmusstörungen kommen, wenn Ibogain an diesem Kanal bindet und seine Funktionsweise verändert [1]. Ein wichtiges Forschungsziel war und ist es deshalb, Moleküle herzustellen, die im Hirn ähnlich wirken wie Ibogain, dabei aber den besagten Ionenkanal meiden. Zudem ist Ibogain stark psychoaktiv. Es kann also langanhaltende Halluzinationen hervorrufen, wenn man genug davon zu sich nimmt. Auch dieser Effekt ist bei psychiatrischen Medikamenten nicht unbedingt gern gesehen. Manche Forschenden suchen deshalb nach nicht-psychoaktiven Ibogain-Analoga, die die suchthemmende Wirkung ohne den Rausch versprechen sollen. Von diesen Ibogain-Analoga haben drei besonders viel Aufmerksamkeit in den Neurowissenschaften erregt: 18-MC, TBG und die oxa-Analoga.
Der erste Schritt
Das älteste Analog von Ibogain wurde in den 90er Jahren von dem amerikanischen Neurowissenschaftler Stanley Glick entwickelt [2] und erregte seitdem gelegentlich auch mediale Aufmerksamkeit. Die Substanz weckte seit ihrer Erfindung immer wieder Aufmerksamkeit, da sie in Tierversuchen ähnlich wie Ibogain den Drogenkonsum von Nagern verringerte. 18-MC zeigte dabei aber weniger Auswirkungen auf Puls und Blutdruck als Ibogain [2]. 18-MC weckte somit bei vielen Forschenden die Hoffnung nach einer sichereren Version von Ibogain.
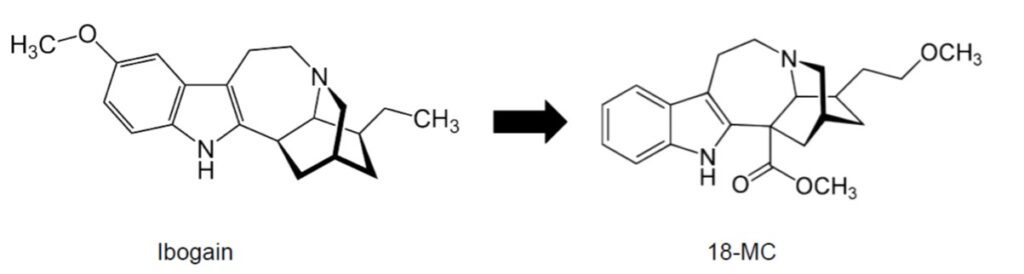
Der volle Name der Substanz lautet 18-Methoxycoronaridin. Das 18-MC-Molekül unterscheidet sich an drei Stellen von Ibogain. Dennoch behält 18-MC die eher ungewöhnliche 3-dimensionale Struktur des Ibogains bei. Die Manipulationen des Moleküls führen dazu, dass 18-MC sich im Hirn etwas anders verhält als Ibogain. Eine wichtige Erkenntnis in dieser Hinsicht ist, dass 18-MC bei Rezeptoren für den Botenstoff Acetylcholin wählerischer ist als Ibogain, außerdem zeigen beide eine hemmende Wirkung an einer ganzen Reihe von verschiedenen Acetylcholinrezeptoren (für die Nerds: es handelt sich dabei um nikotinerge Acetylcholinrezeptoren, insbesondere den α3β4-Subtyp). 18-MC ist dabei aber wählerischer und bevorzugt einen bestimmten Typ von Acetylcholin-Rezeptor. Glick geht aus davon, dass die Wirkung von 18-MC an diesem Rezeptor zentral für die suchthemmende Wirkung von 18-MC ist [3, 4]. Ähnlich wie Ibogain scheint 18-MC zudem auch die Freisetzung von Dopamin in den Belohnungszentren des Gehirns einzuschränken. Allerdings fördert 18-MC nicht so wie Ibogain die Freisetzung von Wachstumsfaktoren an diesen Stellen [5].
Der lange Weg zur Zulassung
Wie bereits angedeutet, durchlief 18-MC eine lange Reihe von vorklinischen Untersuchungen. Die Vorklinik ist das Stadium in der Medikamentenentwicklung, in der Tierversuche genutzt werden, um herauszufinden, ob eine Substanz vielversprechend genug ist, um am Menschen getestet zu werden. In diesen Tests zeigten sich nur kleine Veränderungen im Bewegungsverhalten der Tiere, weshalb viele Forschende davon ausgehen, dass 18-MC weniger psychoaktiv sei als Ibogain [2, 4]. Dennoch zeigten diese frühen Versuche, dass auch 18-MC den Drogenkonsum von Ratten in einer ganzen Reihe verschiedener Tests reduzieren kann [2, 4, 6]. Die dabei erforschten Drogen waren vor allem Opiate, wie Heroin, aber auch Alkohol, Kokain oder Nikotin. Das potenzielle Anwendungsgebiet von 18-MC ist also breit.
18-MC ist bisher das einzige Ibogain-Analog, das es bisher in die klinische Testphase geschafft hat und somit auch an Menschen getestet wurde. Im Jahre 2021 testete die amerikanische Pharma-Firma MindMed 18-MC in einem klinischen Phase-I Versuch. In Phase-I Versuchen erhalten gesunde Teilnehmende aufsteigende Dosen einer Substanz (hier also 18-MC), um herauszufinden, ob und welche Nebenwirkungen zu erwarten sind. Obwohl 18-MC gut toleriert wurde und somit diese Phase der Zulassung bestand, ist es nun wieder ruhig um die Substanz geworden [7]. Laut MindMed liegt dies an Komplikationen mit den amerikanischen Behörden. Mehr vorklinische Studien werden anscheinend von Nöten sein. Ob dies finanziert werden wird, ist unklar. Wie die Zukunft von 18-MC aussieht, ist momentan also ungewiss [8].
Ibogain ohne den Trip?
Ein neueres Ibogain-Analogon ist TBG. Das Kürzel TBG steht in Anlehnung an den Strauch, aus dem das Ibogain gewonnen werden kann (Tabernanthe Iboga) für Tabernanthalog. Dieses Molekül wurde von der amerikanischen Neurowissenschaftlerin Lindsay Cameron entwickelt und im Jahr 2021 erstmals publik gemacht [9]. Camerons Forschungsgebiet bezieht sich allgemein auf den Zusammenhang zwischen dem subjektiven Effekt von Psychedelika und ihrem potenziellen therapeutischen Nutzen. Sie stellt also die Frage, ob der Trip eine Voraussetzung für den medizinischen Nutzen ist oder ob sich dabei um eine Begleiterscheinung handelt, die getrost bei der Entwicklung neuer Medikamente herausgebastelt werden kann. Ob und wie diese beiden Aspekte der Wirkung von Psychedelika zusammenhängen ist nämlich noch eine offene Forschungsfrage.
Zweifelsohne wird die Antwort auf diese Frage bei verschiedenen Psychedelika auch unterschiedlich aussehen. Allerdings ist TBG ein gutes Argument dafür, dass die halluzinogene Wirkung nicht immer eine Voraussetzung für den therapeutischen Effekt sein muss. Cameron und Ihr Team verfolgten nämlich bei der Entwicklung von TBG das Ziel, ein Molekül zu kreieren, welches zwar die therapeutischen Effekte von Ibogain beibehält, dabei aber nicht zu Halluzinationen führt. Cameron argumentiert, dass der halluzinogene Effekt von Psychedelika die weitreichende Anwendung dieser Substanzen in der Medizin hindern könnte und deswegen in der Medikamentenentwicklung eher vermieden werden sollte. Um dies zu erreichen, veränderten sie systematisch einzelne Bausteine des Ibogain-Moleküls.
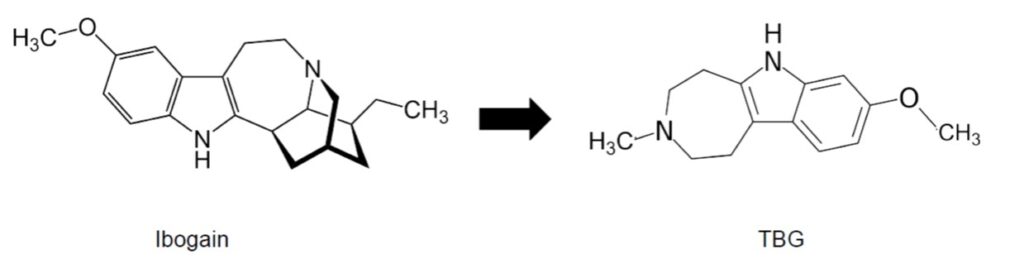
Das ziel dabei war, die Anteile des Moleküls, die für Halluzinationen verantwortlich sind, von denen zu trennen, die sich auf Wachstumsfaktor-Niveaus auswirken. Dabei bezog sich Cameron auf die in meinem letzten Beitrag besprochenen Forschungsergebnisse, die Wachstumsfaktoren wie GDNF mit der anhaltenden suchthemmenden Wirkung von Ibogain in Verbindung bringen. Am Ende dieses Prozesses entstand ein Molekül, welches die 3-dimensionalen Anteile des Ibogains eingebüßt hat und sich deswegen auch im Hirn anders verhält.
Ein anderer Mechanismus
TBG bindet nicht wie Ibogain an den körpereigenen Opioidrezeptoren, sondern stattdessen an dem Serotoninrezeptor an dem auch LSD oder Psylocibin binden. Es scheint diesen Rezeptor allerdings auf eine andere Weise zu aktivieren als diese klassischen Psychedelika. Dies erkannten die Forschenden daran, dass TBG in dem üblichen Tierversuchsprotokoll zur Feststellung von Halluzinogenen Effekten keine Veränderung in dem Verhalten von Ratten produzierte [9].
Einen therapeutischen Effekt scheint TBG jedoch beibehalten zu haben. In Zellkulturen konnte es in einem ähnlichen Maß wie Ibogain das Wachstum von Nervenzellen fördern. Zudem zeigten sowohl Cameron und Ihr Team als auch spätere Versuchsreihen aus anderen Laboren, dass TBG das Konsumverhalten von drogenabhängigen Nagern hemmt [9, 10]. Diese Ergebnisse sind überaus vielversprechend, allerdings steht diese Forschung wirklich noch in den Kinderschuhen. Wenn jedoch keine widersprüchlichen Ergebnisse auftreten, so könnte TBG durchaus in Zukunft ein weiterer Kandidat in der klinischen Suchtforschung werden. Eine interessante Frage wird dann sein, ob die Rückschlüsse aus den Tierversuchen tatsächlich akkurat sind und das Molekül beim Menschen keine subjektiven psychoaktiven Effekte aufweist.
Die neuste Entwicklung des Ibogains
Kommen wir nun zum jüngsten Neuzugang in der Gruppe der Ibogain-Analoga: den oxa-Iboga Substanzen. Hierbei handelt es sich um drei Moleküle, die aus der Arbeit des amerikanischen Neurowissenschaftlers Vaclav Havel entsprangen. Havel und sein Team suchten bei der Entwicklung ihrer Analoga nach einer Ibogain-Alternative, die zu weniger Nebenwirkungen im Herz-Kreislauf-System führen würde. Diejenigen, die den letzten Ibogain-Blogeintrag gelesen haben, werden sich erinnern, dass es vor allem die Wirkung im Herz-Kreislauf-System ist, die für die Ibogain-assoziierten Todesfälle verantwortlich ist.
Zwei Moleküle fanden die Forschenden bei ihren Versuchen: oxa-Noribogain und epi-oxa-Noribogain. Beide Moleküle unterschieden sich nur geringfügig von Noribogain und Ibogain. Allerdings scheinen diese Veränderungen eben diejenigen zu sein, die es brauchte, um die Substanz von ihren schwerwiegendsten Nebenwirkungen zu befreien [11] .
Sicherheit für das Herz
Um sicherzustellen, dass ihr neues Molekül keine Wirkung am Herzen zeigen würde, setzten Havel und sein Team einen Test an noch schlagenden menschlichen Herzzellen aus Spenderherzen ein. Dies ist ein großer Vorteil im Vergleich zur bisherigen Forschung. Die Sicherheit der meisten Ibogain-Analoga (von 18-MC einmal abgesehen) wurden nur an Nagern getestet. Es bestand also immer noch etwas Unsicherheit in der Übertragung der Ergebnisse auf das menschliche Herz. Hier konnte hingegen direkt gezeigt werden, dass die oxa-Substanzen, anders als Ibogain oder Noribogain, keine Arrhythmien im Schlagen dieser menschlichen Herzzellen verursachten.
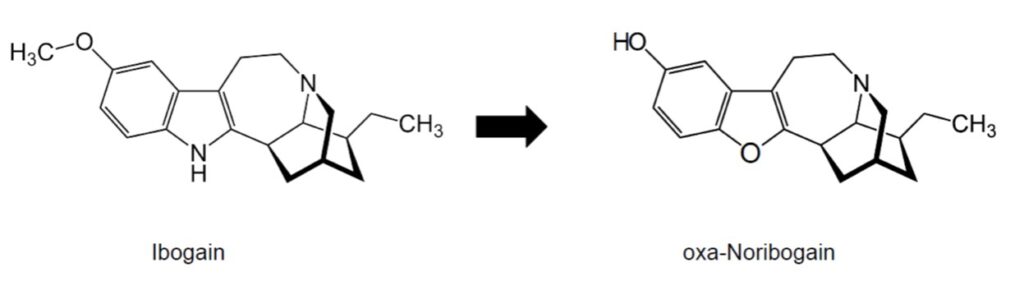
Dennoch konnten die Forschenden beweisen, dass der suchthemmende Effekt von Ibogain bei den oxa-Analoga nicht nur erhalten, sondern sogar gesteigert wurde. Dies überprüften sie in einem Tierversuch an Opioid-abhängigen Ratten. Es handelt sich hierbei also eindeutig um eine sehr vielversprechende Gruppe von Molekülen für die zukünftige Suchtforschung.
Wie genau diese suchthemmende Wirkung zustande kommt, ist bei oxa-Noribogain genauso unklar wie bei Ibogain. Die Erklärungsansätze, die Ich im letzten Ibogain-Beitrag geschildert habe, gelten aber für beide Substanzen gleichermaßen. Die oxa-Analoga verhalten sich im Hirn recht ähnlich zu Ibogain. Die beiden Substanzen binden weitgehend an den gleichen Rezeptoren, nur tun sie dies teilweise unterschiedlich gern (man spricht dabei von veränderten Rezeptor-Affinitäten). Havel und sein Team gehen davon aus, dass die oxa-Analoga ähnlich wie Ibogain Auswirkungen auf endogene Wachstumsfaktoren haben könnten, dies gilt es allerdings noch zu beweisen [11].
Überhaupt fehlt bislang die weiterführende Forschung zu den oxa-Analoga. Noch hat niemand, außer den Wissenschaftlern, die oxa-Ibogain entwickelt haben, zu dieser Analog-Klasse publiziert. Allerdings befindet sich diese weiterführende Forschung gerade in Arbeit. Am Mannheimer Zentralinstitut für Seelische Gesundheit arbeitet der Neurowissenschaftler Ivan Skorodumov mit Ibogain-Analoga und erforscht ihre Anwendung in der Behandlung von Alkoholabhängigkeit.
Noch Fragen?
Im nächsten Monat wird an dieser Stelle ein exklusives Interview mit Ivan Skorodumov erscheinen. Wer also an Ibogain und Neurowissenschaften interessiert ist, der sollte nächsten Monat dringend wieder den Weg zu Hirn und Weg finden. Falls Ihr Fragen habt, die Ihr gerne in diesem Interview beantwortet haben möchtet, dann schreibt Sie mir gerne in die Kommentare unter diesem Beitrag!!
Fazit
Die Hoffnungen, die viele Menschen dem Ibogain gegenüber hegen sind riesig. Viele träumen von einer Welt, in der schwerwiegende Suchterkrankungen schnell und nachhaltig geheilt werden können. Die Forschungslage ist allerdings noch dünn. Die bisherigen Studien erscheinen zwar fast einstimmig vielversprechend, dennoch betonen viele Forschende zurecht ihre Zweifel an der Belastbarkeit der Ergebnisse. Auch gibt es viele, die das Ibogain mit Sorge betrachten. Im Angesicht der potenziell schwerwiegenden Nebenwirkungen sind auch diese Sorgen durchaus berechtigt. Eine große Chance, die Ibogain aber dennoch für die Suchtforschung bietet, ist die Entwicklung der Ibogain-Analoga. Die molekulare Struktur des Ibogain kann als Wegweiser für neuere und sicherere Medikamente genutzt werden. Dies wird ohne Zweifel weiterhin ein heißes Thema in den Neurowissenschaften bleiben.
Literaturverzeichnis
[1] Wasko M. J., Witt-Enderby P. A., Surratt C. K.: DARK Classics in Chemical Neuroscience: Ibogaine. ACS chemical neuroscience 9, 2475–2483 (2018).
[2] Glick S. D., Maisonneuve I. M., Szumlinski K. K.: 18-Methoxycoronaridine (18-MC) and ibogaine: comparison of antiaddictive efficacy, toxicity, and mechanisms of action. Annals of the New York Academy of Sciences 914, 369–386 (2000).
[3] Glick S. D., Sell E. M., Maisonneuve I. M.: Brain regions mediating alpha3beta4 nicotinic antagonist effects of 18-MC on methamphetamine and sucrose self-administration. European journal of pharmacology 599, 91–95 (2008).
[4] Pace C. J., Glick S. D., Maisonneuve I. M., He L.-W., Jokiel P. A., Kuehne M. E., Fleck M. W.: Novel iboga alkaloid congeners block nicotinic receptors and reduce drug self-administration. European journal of pharmacology 492, 159–167 (2004).
[5] Carnicella S., He D.-Y., Yowell Q. V., Glick S. D., Ron D.: Noribogaine, but not 18-MC, exhibits similar actions as ibogaine on GDNF expression and ethanol self-administration. Addiction biology 15, 424–433 (2010).
[6] Rezvani A. H., Glick S. D., Levin E. D.: Oral 18-Methoxycoronaridine (18-MC) Decreases Nicotine Self-Administration in Rats: Neuroscience of Nicotine. Elsevier 2019.
[7] MindMed: Press Release: MindMed Completes Dosing 18-MC Phase 1 Study. https://mindmed.co/news/press-release/mindmed-completes-dosing-18-mc-phase-1-study/.
[8] Hallifax J.: MindMed Shelves 18-MC for Opioid Use Disorder and Further Cuts Pipeline. https://psychedelicspotlight.com/mindmed-shelves-18-mc-for-opioid-use-disorder-and-further-cuts-pipeline/.
[9] Cameron L. P., Tombari R. J., Lu J., Pell A. J., Hurley Z. Q., Ehinger Y., Vargas M. V., McCarroll M. N., Taylor J. C., Myers-Turnbull D., Liu T., Yaghoobi B., Laskowski L. J., Anderson E. I., Zhang G., Viswanathan J., Brown B. M., Tjia M., Dunlap L. E., Rabow Z. T., Fiehn O., Wulff H., McCorvy J. D., Lein P. J., Kokel D., Ron D., Peters J., Zuo Y., Olson D. E.: A non-hallucinogenic psychedelic analogue with therapeutic potential. Nature 589, 474–479 (2021).
[10] Heinsbroek J. A., Giannotti G., Bonilla J., Olson D. E., Peters J.: Tabernanthalog Reduces Motivation for Heroin and Alcohol in a Polydrug Use Model. Psychedelic medicine (New Rochelle, N.Y.) 1, 111–119 (2023).
[11] Havel V., Kruegel A. C., Bechand B., McIntosh S., Stallings L., Hodges A., Wulf M. G., Nelson M., Hunkele A., Ansonoff M., Pintar J. E., Hwu C., Abi-Gerges N., Zaidi S. A., Katritch V., Yang M., Javitch J. A., Majumdar S., Hemby S. E., Sames D.: Novel Class of Psychedelic Iboga Alkaloids Disrupts Opioid Use 2021.
Bildquellen
Beitragsbild: pixabay.com
Strukturformeln: Wikimedia.org


Die Forschung an Ibogain-Analoga muss letztlich auch finanziert werden. Je eher daraus ein Blockbuster-Medikament wird, desto eher findet sich ein Investor. Das Einsatzgebiet wäre wohl die Behandlung von Suchtkranken und zwar in der Rehabilitation, denn aktiv Süchtige sind wohl kaum potenzielle Klienten, aber Süchtige, die von der Droge wegkommen wollen sind es sehr wohl, denn die Rückfallquote ist ja sehr gross. Einige Suchtexperten sprechen ja sogar davon, dass Opioid-Süchtige nie mehr völlig frei von ihrer Sucht werden und sie deshalb lebenslang abstinent bleiben müssen. Wenn nun Ibogain-Analoga das typische Craving (das intensive Verlangen nach Stoff) dieser Suchtpatienten zurückbinden können, dann wären diese vor einem Rückfall geschützt. Allerdings bezweifle ich dennoch, dass ein solches Ibogain-Analog das Zeug zum Blockbuster hat. Vielleicht sollte man einmal testen, ob Ibogain-Analoga auch übermässigen Hunger bändigen, denn Fettsüchtige, die sich von ihrer Fettsucht befreien wollen, die gibt es zuhauf.
Hallo,
in der Tat ist die Finanzierung immer eine der größten Hürden bei der Entwicklung neuer Medikamente. Allerdings steigt ja momentan generell das Interesse an psychedelischen Substanzen in der psychiatrischen Forschung (und dazu kann man Ibogain im weitesten Sinne ja auch zählen). Es bleibt also spannend. Ibogain und die Analoga sind dabei auf jeden Fall wichtige Kandidaten, auch wenn sie mit Sicherheit nicht an erster Stelle stehen.
Zum Effekt von Ibogain auf nicht-substanzgebundene Verhaltenssüchte, wie etwa beim Essen (man spricht hier übrigens von einer Binge-Eating-Störung) oder auch beim Glücksspiel, gibt es bisher tatsächlich keinerlei Daten. Mit der Hypothese, dass der Effekt von Ibogain auf Veränderungen in der Verschaltung von Neuronen in Motivationszentren zurückzuführen ist, wäre eine solche Anwendung des Medikaments aber durchaus vereinbar. Allerdings ist nicht völlig klar, wie sich die Hirnfunktionen zwischen Drogen- und Verhaltenssüchten unterscheiden. Es scheint Überlappungen aber auch Unterschiede zu geben (https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10148787/). Zudem ist ja auch noch nicht abschließend geklärt, in welchen Hirnregionen Ibogain zu erhöhten GDNF und BDNF Konzentrationen führen kann. Dies könnte durchaus auch außerhalb der bisher erforschten Regionen der Fall sein. Diese Frage wäre also tatsächlich äußerst spannend!
Vielen Dank für Ihre Anmerkungen!