Elektrogenetik: Ferngesteuertes Insulin für Typ 1-Diabetiker
Im Jahr 1898 präsentierte Nikola Tesla auf der Weltausstellung in New York ein ferngesteuertes Modellboot, das er mithilfe von Radiowellen steuerte. Der Sender der Radiowellen befand sich in einem Kasten, der vor Tesla stand. Der Empfänger auf dem Boot war ein Kanister mit Metallpulver, das sich beim Empfang eines Radiosignals so ausrichtete, dass ein Strom floss. Kombiniert mit verschiedenen weiteren Schaltelementen konnte Tesla so den Elektromotor steuern, der die Schiffsschraube antrieb. Heute gehören ferngesteuerte Drohnen, Fahrzeuge und Raketen längst zur Standard-Ausrüstung von Militär und Raumfahrt. Nun wollen Ärzte diese Technologie, die sich, seit Tesla rasant weiterentwickelt hat, auch in der Medizintechnik zum Wohle von Typ-1 Diabetikern einsetzen.
Typ-1-Diabetes und Betazellen
Bei Typ-1-Diabetikern produziert die Bauchspeicheldrüse nicht mehr genügend oder gar kein Insulin. Betroffene müssen ihrem Körper daher ein Leben lang Insulin zuführen. Betazellen sind die Zellen in der Bauchspeicheldrüse, die Insulin herstellen und ins Blut ausschütten. Betazellen befinden sich in kleinen Zellhaufen, die wie Inseln im Gewebe der Bauchspeicheldrüse verteilt sind. Diese werden nach ihrem Entdecker als Langerhans-Inseln bezeichnet. Von diesen Inseln leitet sich auch der Name „Insulin“ ab (von lateinisch insula „Insel“). Über ein dichtes Netz sehr feiner Blutgefäße in den Langerhans-Inseln stehen die Betazellen direkt mit dem Blutkreislauf in Verbindung. Steigt der Gehalt an Glukose (Traubenzucker) im Blut, wird in den Betazellen das Insulingen angeschaltet. Anschließend schütten die Betazellen das Insulin ins Blut aus. Der Blutzuckerspiegel sinkt.
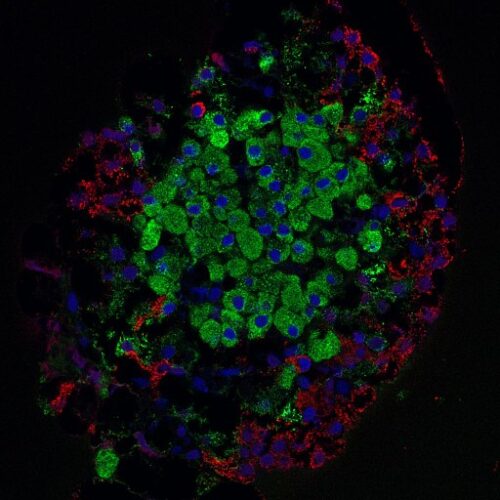
Eine künstliche Langerhans-Insel
Ein Forscherteam unter der Leitung von Martin Fussenegger, Professor für Biotechnologie und Bioingenieurwissenschaften an der ETH Basel, hat eine Studie veröffentlicht, in der erstmals untersucht wird, wie die Anschaltung des Insulingens direkt über elektrische Signale aktiviert und reguliert werden kann. Die Studie, die in der Fachzeitschrift Science veröffentlicht wurde [1], beschreibt den Prototyp eines ferngesteuerten Insulin-produzierenden Bioreaktors, den die Forscher in Mäusen mit Typ-1 Diabetes getestet haben.
Der Bioreaktor, eine Art künstliche Langerhans-Insel, besteht aus mehreren Bestandteilen, darunter eine Leiterplatte und eine Kapsel mit künstlich hergestellten menschlichen Betazellen, die so gestaltet sind, dass sie auf die Ladungsumkehr an ihrer Zellmembran mit einer raschen Freisetzung von Insulin aus intrazellulären Speicherbläschen reagieren. Die Kapsel ist mit einer speziellen Membran umgeben, die Hormone und Nährstoffe ungehindert passieren lässt, jedoch den Kontakt zu den körpereigenen Immunzellen unterbindet. Auf Medikamente zur Unterdrückung des Immunsystems kann also verzichtet werden.
Die Leiterplatte und die Kapsel sind durch ein winziges Kabel verbunden. Der Bioreaktor wird direkt unter die Bauchdecke eingepflanzt und ein Funksignal außerhalb des Körpers aktiviert die Elektronik in der Leiterplatte, die anschließend ein Signal direkt an die Betazellen in der Kapsel überträgt. Das Signal löst eine Ladungsumkehr an der Zellmembran aus, sodass Kalziumionen in die Betazelle einströmen und Kaliumionen ausströmen. Die vorübergehende Ladungsumkehr schaltet das Insulingen an, und als Folge davon wird Insulin zur Zellmembran transportiert, wo es dann freigesetzt wird.
In dieser Studie testeten die Forscher den Bioreaktor an Mäusen, die Typ-1-Diabetes hatten, und stellten fest, dass der Bioreaktor den normalen Blutzuckerspiegel in Echtzeit wiederherstellen konnte, wobei der Insulinspiegel innerhalb von 10 Minuten seinen Höhepunkt erreichte.
Die Wissenschaftler behaupten, dass der Bioreaktor theoretisch in den Körper eines Typ-1-Diabetikers implantiert und mit einer App auf dessen Smartphone verbunden werden könnte. Sobald der Patient isst und sein Blutzuckerspiegel zu steigen beginnt, könnte er über die App auf seinem Handy ein elektrisches Signal auslösen, und kurze Zeit später könnten die Betazellen im Bioreaktor dazu veranlasst werden, die erforderliche Menge Insulin freizusetzen, um den Blutzuckerspiegel des Patienten zu regulieren.
Ein großes Problem des Bioreaktors ist die Logistik: Wie werden die Betazellen in der Kapsel ersetzt? Die derzeitige Arbeit des Teams legt nahe, dass dies alle drei Wochen erfolgen müsste. Da es sich bei diesen Betazellen um Designerzellen handelt, wäre das nächste wichtige Designfeature die Langlebigkeit der Zellen.
Weiterführende Literatur
Goethes Zauberlehrling 2.0: Der Biohacker im Smart Home
Genexpression im Gehirn live beobachten!


Wenn man nun noch einen Glucose-Sensor einbauen würde, dann würde das ganze vollautomatisch funktionieren.
Der Glucose-Sensor kann entweder elektronisch funktionieren, oder, noch besser, direkt genetisch in die Betazellen eingebaut werden.
Ja, da stimme ich Karl Bednarik zu: Die hier vorgestellte künstliche Langerhans-Insel ist erst der Anfang und sollte noch nicht in Patienten implantiert werden, denn inzwischen gibt es bereits synthetische biologische Schaltkreise, welche beispielsweise so gestaltet werden können, dass sie eine biologische Funktion aktivieren, wenn ein bestimmtes Ereignis eintrifft- ein Ereignis wie etwa, dass der Glukosespiegel einen bestimmten Wert überschreitet.