„Another brick in the wall“ – Die Schutzmauer des Hirntumors überwinden
Für ihre Bewerbung um den KlarText-Preis für Wissenschaftskommunikation 2022 in der Kategorie Neurowissenschaften veranschaulichte Julia Benzel was sie in ihrer Promotion erforscht hat.
Hirntumore sind von einer Schutzmauer umgeben, auch Blut-Tumor-Schranke genannt. Diese Schutzmauer kann anders als die Blut-Hirn-Schranke im gesunden Gehirn aufgebaut sein. Ein genaues Verständnis der tumortypischen Schutzmauer ermöglicht es, Medikamente raffiniert die Mauer überwinden zu lassen.
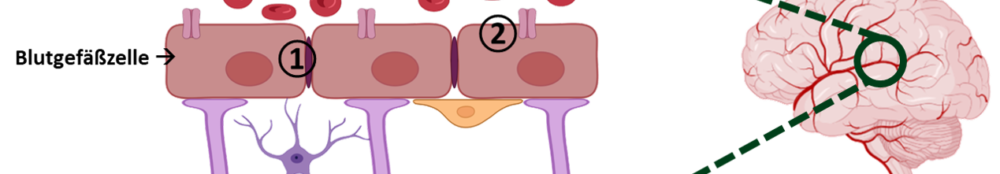
„Ey du kommst hier nicht rein“. Wie in einem Club wird im Hirngewebe streng kontrolliert, wer Eintritt erhält. Das gesunde Hirn wird über das Blut zwar ständig mit Sauerstoff und Nährstoffen versorgt. Es soll allerdings nicht alles, was im Blut transportiert wird, in das Gehirn hineingelangen. Deshalb sind die Blutgefäße im Gehirn wie eine Schutzmauer aufgebaut, die Eindringlinge abschirmt und dafür sorgt, dass nur ausgewählte Nährstoffe an bestimmte Orte im Hirngewebe gelangen. In der Fachsprache nennt man diese Mauer Blut-Hirn-Schranke. Unsere Blutgefäßzellen bilden die Backsteine der Mauer. Sie liegen eng nebeneinander und verhindern damit, dass unbemerkt gefährliche Substanzen über Lücken oder durchlässige Stellen in das Gehirn eintreten. Über eine Art Mörtel werden die Backsteine zusammengehalten und verbunden. Der Mörtel stellt hierbei dichte Verbindungsstellen in der Schutzmauer dar. Diese Stellen werden Tight-Junction-Komplexe genannt. „Tight junction“ bedeutet „dichte Verbindung“. Sollten wider Erwarten giftige Stoffe in das Gehirn gelangen, gibt es weitere Schutzmechanismen, die eingreifen: Eiweißstoffe, die als Türsteher arbeiten. Wenn die Türsteher-Eiweiße fremde Stoffe wie zum Beispiel Medikamente im Gehirn bemerken, schicken sie diese wieder zurück in die Blutbahn. Die Türsteher-Eiweißstoffe heißen in der Fachsprache Efflux-Pumpen. „Efflux“ bedeutet, dass etwas austritt.
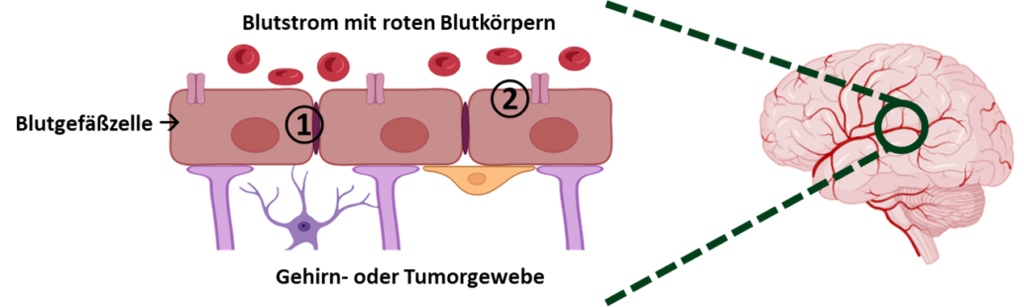
Während die Blut-Hirn-Schranke für das gesunde Gehirn sehr wichtig ist, wird sie bei Hirntumoren zum Verhängnis. Denn Medikamente werden in der Regel über die Blutbahn transportiert und können dann nicht aus dem Blut in den Hirntumor gelangen. Auch Hirntumore haben eine solche Schutzmauer. Diese weist jedoch Besonderheiten und Unterschiede zur gesunden Blut-Hirn-Schranke auf und wird Blut-Tumor-Schranke genannt.
Die Bedeutung der Blut-Tumor-Schranke bei Hirntumoren von Kindern ist in der Wissenschaft bislang nicht gut erforscht. Um die Therapiemöglichkeiten und Überlebenschancen für Kinder mit Hirntumoren zu verbessern, wollten wir den Besonderheiten der Blut-Tumor-Schranke auf den Grund gehen. Außerdem wollten wir testen, welche Medikamente diese Barriere überwinden und damit den Tumor bekämpfen. Um Hirntumore besser zu verstehen und die therapeutischen Optionen für Kinder mit Hirntumoren zu erweitern, sind Modelle im Labor, die die Vorgänge im Körper der Patient*innen gut widerspiegeln, sehr wichtig. Die Vorgänge im Körper können durch Labormodelle nachgebildet werden, zum Beispiel mit Mäusen, an denen die Wirksamkeit von Medikamenten getestet werden kann. Es war bisher nicht bekannt, ob diese Forschungsmodelle die Anzahl der vorhandenen Tight-Junction-Komplexe und Efflux-Pumpen bei jungen Krebspatient*innen richtig wiedergeben. Eine Art von Hirntumoren in Kindern mit bisher schlechten Überlebenschancen sind Ependymome. Im Rahmen unserer Forschung zur Blut-Tumor-Schranke untersuchten wir die RNA von Ependymomen. Die RNA kann man sich als eine von den Genen abgeschriebene Bauanleitung vorstellen. Sie dient als Anleitung zum Aufbau von einzelnen Eiweißen. Wir sahen, dass in Ependymomen die Anleitungen einen anderen Aufbau der Schutzmauer zeigte als im gesunden Gehirn. Mithilfe weiterer Untersuchungen ließen sich diese Ergebnisse nicht nur auf RNA-Ebene, sondern auch auf Eiweißebene bestätigen. Ependymome können diagnostisch in verschiedene Gruppen unterteilt werden. Wir fanden heraus, dass die Schutzmauern der Tumore für jede einzelne Ependymom-Gruppe – je nach Wachstumsort im Gehirn – besondere Merkmale aufweisen. Viele der verwendeten Mausmodelle spiegelten die wichtigsten Eigenschaften der Blut-Tumor-Schranke wider. Insgesamt stellte sich so heraus, dass die meisten der vorhandenen Labormodelle sehr gut geeignet sind, Wirkstoffe auf ihr Eindringen über die Blut-Tumor-Schranke in den Hirntumor zu testen.
Neben der Blut-Tumor-Schranke untersuchten wir auch die Fähigkeit von Medikamenten, die Schutzmauern zu überwinden. Wir stellten uns die Frage, wie ein Medikament aussehen muss, um leichten Eintritt in den Club, also das Gehirn und den Hirntumor, zu erhalten. Die genaue Betrachtung der Medikamenteneigenschaften soll die Beurteilung und Vorauswahl von geeigneten Wirkstoffen für eine erfolgreiche Therapie verbessern.
Für unsere Untersuchung luden wir gleichsam über 4000 Partygäste zu einem Mega-Event in einem der angesagtesten Clubs ein, das heißt: Wir analysierten über 4000 verschiedene Medikamente und entwickelten ein Computermodell, das in der Lage ist, Zusammenhänge von Wirkstoffeigenschaften und der Überwindung der Schutzmauern zu finden. Wir nutzten chemische und physikalische Eigenschaften der Wirkstoffe, wie zum Beispiel Größe und Oberfläche, sowie Bilder des chemischen Aussehens, so genannte Strukturformeln – getreu dem Motto „Aussehen öffnet Türen“. Das Computermodell half uns, die vielversprechendsten Medikamente für weiterführende Untersuchungen auszuwählen. Wir führten neben den Computeranalysen weitere Experimente mit den aussichtsreichsten Medikamenten durch. Hierbei untersuchten wir in Zellen, ob Wirkstoffe von bestimmten Efflux-Pumpen erkannt werden. Die chancenreichsten Medikamente wurden direkt im Gehirn von behandelten Mäusen gemessen. Hierzu reichen sehr wenige Tiere aus, um aufzuschlüsseln, ob Medikamente in ausreichenden Mengen im Gehirn ankommen, um den Tumor zu behandeln. Auch Diskussionen mit wissenschaftlichen Kooperationspartner*innen nutzten wir, um eine noch bessere Auswahl an Medikamenten zu treffen. Wir konnten sehen, dass Wirkstoffe die klein und dünn sind und dadurch trotz Tight-Junction-Komplexen zwischen den Blutgefäßzellen Einlass finden oder Medikamente, die vom Türsteher durchgelassen werden, besonders gut für die Behandlung von Hirntumoren geeignet sind. Tatsächlich konnten wir staunend beobachten, wie sich besonders zierliche und geschmeidige Partygäste unbemerkt von der scharfäugigen Security in den Club schmuggeln ließen, während andere durch ihren Charme die Wachleute dahinschmelzen ließen. Ausgebuffte Clubgänger lenkten die Türsteher dergestalt ab, dass auch Typen, denen man keine Chancen eingeräumt hätte, in die Partyszene vordringen konnten. Diese Strategie nutzen wir mit Medikamenten, die das Türsteher-Eiweiß P-gp belagern, um Krebszellen-abtötenden Wirkstoffen den Weg zum Hirntumor zu bahnen. In Kombination damit verwendeten wir das krebszellenabtötende Medikament mit dem Namen Actinomycin D. Es wird seit ca. 70 Jahren als Wirkstoff für verschiedene Krebsarten genutzt. Die Fähigkeit von Actinomycin D, die Schutzmauer zu überwinden, ist bisher nicht systematisch untersucht worden. Das Medikament zeigt in Tumorzellen von einigen Ependymompatient*innen vielversprechende Ergebnisse. Aus diesem Grund untersuchten wir Actinomycin D systematisch im Labor und fanden heraus, dass die Medikamentenkonzentration im Gehirn ausreichen könnte, um Tumore von Patient*innen hiermit zu behandeln.
Wir setzten all unsere Versuche mit Computer-, Tumorzell- und Mausmodellen in einem „Blut-Tumor-Schranken-Werkzeugkasten“ zusammen. Im Moment arbeiten wir daran, Teile des Werkzeugkastens zum Beispiel in Form einer App leichter für andere Forscher*innen zugänglich zu machen. Um die Vorauswahl an Medikamenten, die für kindliche Hirntumore eingesetzt werden können, noch weiter einzugrenzen, wollen wir zukünftig routinemäßig Versuche aus dem „Blut-Tumor-Schranken-Werkzeugkasten“ nutzen. Damit sollen neue Therapiemöglichkeiten für Patient*innen gefunden werden und Medikamente ausgewählt werden, die „freien Eintritt“ in den Club erhalten.
Dr. Julia Benzel studierte Humanbiologie und Tumorbiologie an der Philipps-Universität Marburg. In ihrer Promotion und als PostDoc untersuchte sie kindliche Hirntumore wie Ependymome mit dem Fokus auf der Blut-Hirn-Schranke in der Forschungsgruppe von Prof. Dr. Pajtler und Abteilung von Prof. Dr. Pfister am Hopp-Kindertumorzentrum (KiTZ) in Heidelberg. Hierzu etablierte sie nach einem Forschungsaufenthalt an der Kinderklinik St. Jude Children’s Research Hospital in Memphis, USA eine “Drug Exposure Pipeline”, um geeignete Behandlungsmethoden für Kinder mit Hirntumoren zu finden.

