Ist Entropie Wärme? Thermodynamische Fußnote
Seit jeher kapern Physiker Wörter. Man ist dabei großzügig. Mein Physiklehrer in der Schule erklärte uns, Kraft habe eine wohldefinierte Bedeutung, es sei für ihn jedoch OK, wenn wir z.B. von „Kraft Scheibletten Käse“ reden. Nicht akzeptable hingegen sei der Begriff „Atomkraft“, denn er sei irreführend falsch (ich trug damals einen „Baum ab? Nein Danke“-Sticker, da wollte er das vielleicht vorsorglich klären).
Es kommt also auf den Bezug an. Je weiter der Bezug weg von der Physik liegt, desto eher darf man ungestraft Wörter im Gespräch mit einem Physiker auch weiterhin “anders” verwenden. Sheldon Cooper würde wohl selbst die Kraft Scheiblette kommentieren, aber letztlich auch sein OK geben, da „Kraft“ hier der Name des Gründers, James L. Kraft, ist und nicht etwa eine vitalisierende Wirkung der Lebensmittel andeuten sollte. Shelden würde natürlich fortfahren, dass es interessant zu erwähnen sei, dass Helmholtz einen Aufsatz “Über der Erhaltung der Kraft” schrieb, in dem er über die Verdauung von Nahrung, nicht notwendigerweise nur weiche Käse Scheibletten (Vorsicht: Laktoseintoleranz!), sich seine Gedanken machte und erst durch seine Englandreisen wurde sich Helmholtz seines Fehlers bewusst, nämlich dass der Begriff „Kraft“ durch „Energie“ ersetzt werden muss.
Über die Bedeutung dieser Wortverwechselung wurden Dissertationen geschrieben. Denn dieser Aufsatz gilt als Vorläufer des ersten Hauptsatzes der Thermodynamik. Der Kampf um Wörter hat Tradition in der Thermodynamik.
Ist Entropie eigentlich Wärme?
Neu ist allerdings der Versuch, dass ein von der Physik gekapertes Wort, nämlich Wärme, innerhalb der Physik für eine andere Größe zurückerobert werden soll. Ja, ich schreibe zurückzuerobern, denn zumindest als „reduzierte Wärme“ wurde ein Vorläufer der Entropie früher bezeichnet. Doch es geht nicht um den ursprünglichen Besitzer.
Es geht darum:
Every time one has to lecture a course on classical theoretical physics one faces the problem of introducing pairs of new variables simultaneously.
So sah Hans-Jürgen Borchers die Probleme der Lehre [1]. Er war mein Thermodynamiklehrer an der Hochschule. Dass wir neue Größen einführen können, liegt wiederum an der Tatsache, dass wir uns auf andere Größen verlassen, die zuvor definiert wurden. In der Thermodynamik stützen wir uns auf Energieformen und Borchers führt seine Betrachtung so fort, dass er zeigt, wie man gleich am Anfang zur Entropie gelangen kann (nämlich über eine absolute Temperaturskala). Man beginnt also die Thermodynamik mit dem nullten und zweiten Hauptsatz. Im Folgenden werde ich mich nicht mehr auf Borchers beziehen sondern meine eignen Gedanken äußern.
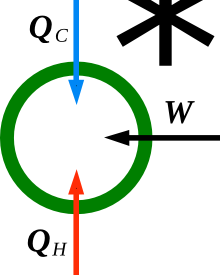
Wenn man die Wärmelehre mit den Begriffen Temperatur und Entropie beginnt, wird unweigerlich Entropie nah an den Begriff „Wärme“ gerückt. So nah wie es Temperatur auch schon ist. Nun bezeichnet „Wärme“ aber eine eigenständige Größe, die üblicherweise als \(Q\) uns im ersten Hauptsatz begegnet.
Dabei sollte man sich klar machen, dass die Reihenfolge prinzipiell verhandelbar ist. Hierbei geht es nicht um Didaktik sondern um die Systematik des Fachs Physik.
Bei Borchers wurde Jakob Yngvason promoviert, der zusammen mit Elliott H. Lieb den Aufsatz “The Mathematical Structure of the Second Law of Thermodynamics” (arXiv) schrieb. Diese Entwicklung in der Thermodynamik wird auch als Entropieprinzip von André Thess bezeichnet und in einer leichter lehrbaren Struktur gelehrt:
Entropie ist die wichtigste und zugleich am schwierigsten verständliche Größe der Thermodynamik. Viele Menschen sind mit ihrer traditionellen Herleitung unzufrieden, weil sie sich entweder auf Begriffe wie “Temperatur” und “Wärme” [hier ist mit Wärme natürlich \(Q\) gemeint, Anmerkung MAD] stützt, die sich nur mittels der Entropie genau definieren lassen, oder weil sie Konzepte wie “molekuare Unordnung” enthält, die nicht in eine makroskopische Theorie gehören. Die Physiker Elliott Lieb und Jakob Yngvason haben im Jahre 1999 eine Formulierung der Thermodynamik entwickelt, die frei von den genannten Mängeln ist. In der vorliegenden Kompaktvorlesung sollen die Grundgedanken dieser Formulierung sowie ihre praktischen Anwendungen auf elementare Weise vermittelt werden. Die Lieb-Yngvason Formulierung fußt auf dem Begriff der adiabatischen Erreichbarkeit, aus dessen Eigenschaften das Entropieprinzip als Hauptaussage der Thermodynamik abgeleitet wird.
Das Entropieprinzip übernimmt die zentrale Rolle der Hauptsätze der Thermodynamik, die Temperatur verwandelt sich aus einem Grundbegriff in eine abgeleitete Größe, der Begriff der Wärme wird entbehrlich. Anschauliche Beispiele zur Anwendung des Entropieprinzips runden die Darstellung ab.
(Hervorhebung von mir. Zitat von hier, Ankündigung Blockvorlesung, Prof. André Thess.)
Der Karlsruher Physikkurs und die Neudarstellung der Wärmelehre von Georg Job (der wesentlich am KPK mitgearbeitet hat) gehen in eine ähnliche Richtung, wobei ich diese Werke weder in ihrer Didaktik bewerten kann, noch sie genau genug kenne, um Unterschiede zu dem Entropieprinzip von Thess klären zu können.
Für eine Neustrukturierung der Thermodynamik spricht aber viel. Das sind eben nicht allein didaktische Feinheiten. Sollte sich diese Neustrukturierung in den nächsten Jahrzehnten durchsetzen, dann wird der Begriff Wärme auch stärker mit dem Begriff Entropie verbunden sein. Vielleicht wird Entropie in diesem Rahmen sogar eine eigenständige Einheit bekommen. Oder auf ihre Einheit ganz verzichten müssen. Wenn man z.B. die Boltzmann-Konstante zu den Altlasten der Physik zählte, wäre die Entropie ohne Einheit (weil die Temperatur dann in Joule messen würde). Das scheint mir sinnvoll, denn man sollte nicht eine Ausgangsgröße in einer zusammengesetzten Einheit messen.
Entropie ist also in dem heutigen Lehrsystem keine Wärme. Das hat so auch nie jemand behauptet (es wurde aber unterstellt). Abwegig wäre eine Umbenennung jedoch gar nicht. Vorstellungen, die wir Menschen mit dem Begriff Wärme verbinden, sind auch bei dem ansonsten sehr abstrakten Begriff Entropie durchaus hilfreich. Wer nach einer Alternative für \(Q\) sucht, kann sich mit „thermischer Arbeit“ helfen. Diesen Begriff fand ich bei Job.
Ein spannende Frage wäre folgende:
Würden in einer fiktiven Gesellschaft, zu deren hundertjähriger Denktradition es gehört, die Größe \(S\) nicht Entropie sondern Wärme zu nennen, den dortigen Schülern, Studenten wie Wissenschaftlern Thermodynamik nicht so große Schwierigkeiten machen? Und wie würde die Gesellschaft, in der es zum Allgemeinwissen gehörte, dass Wärme (was wir Entropie nennen) ausschließlich zunimmt, die „Globale Erwärmung“ bewerten? Das alles muss hypothetisch bleiben.
Literatur
[1] Borchers, H. J. (1985). Some remarks on the second law of thermodynamics. Reports on mathematical physics, 22(1), 29-48.


Dass das “nie jemand so behauptet” hat, ist aber schon eine etwas schiefe Formulierung. Die Aussage im KPK, Band 1 Sek II, ist, dass für das, “was man umgangssprachlich ‘Wärmemenge’ nennt, oder auch einfach ‘Wärme'” der physikalische Name “Entropie” sei, dann ist diese Aussage eben für 90% der Darstellungen der Physik falsch – dort ist der physikalische Name eher “Wärmeenergie”.
Und solange ein Schüler keine Hintergrundinformation zum Thema “ach übrigens, wir machen hier etwas anderes als (fast) alle anderen” bekommt, sind Missverständnisse vorprogrammiert.
Das ist einfach handwerklich schlecht gemacht – und leider nicht das einzige Beispiel dafür, wie der KPK den Umstand, dass es auch andere Darstellungsweisen gibt, unter den Teppich kehrt.
Ob es schlecht oder gut ist (und wie und wann man es ggf. macht) Schülerinnen und Schüler vor die Nase zu stoßen, dass man etwas anders als alle anderen macht, will ich nicht beurteilen.
Mir geht es auch nicht um den KPK. (Wohl aber auch ein wenig um die Ehrenrettung der Wissenschaftler hinter dem KPK, denen man unterstellt, Dinge falsch zu machen, die evtl (!) nur wirklich Innovativ sind.)
Eigentlich will ich nur darauf Aufmerksam machen, dass man sehr wohl immer an Wärme denken kann, wenn man Entropie hört (und einem eine Vorstellung fehlt). Natürlich muss man dann wissen, das es nicht um das Q geht.
…aber ist es denn wirklich so, dass man immer an Wärme denken kann? Beim Alltagsbegriff Wärme ist doch eigentlich immer die Temperatur mit drin: wenn es wärmer wird, steigt die Temperatur; führe ich Wärme ab, dann sinkt sie. Entropie kann ja nun auch wachsen, ohne dass die Temperatur sich ändert (und wenn ich’s richtig anstelle doch wohl auch bei sinkender Temperatur – ich entziehe dem System Wärmeenergie, lasse seine Entropie aber gleichzeitig als Mischungsentropie ansteigen). Übersehe ich da etwas? In solchen Fällen verhält sich Entropie anders, als man es von der Alltagswärme erwartet. Und das ist ein Anzeichen darauf, dass die Gleichsetzung doch nicht so gut klappt.
Aber gleiche Fälle würden “Probleme” für Q machen, was wir mit Wärme wörtlich gleichsetzen. Und selbst “normale” Fälle machen Probleme, wenn wir Q Wärme nennen. Siehe dazu die anderen Fußnoten, insbesondere die zu Reibung.
Übrigens, ich würde ja auch (heute) nicht (mehr) S wirklich Wärme nennen wollen. Entropie ist ein schönes Wort. Aber das wir im Hinterkopf Wärme denken, hilft meines Erachtens. Und es hilft nicht, bei Q an Wärme zu denken.
Den Einwand verstehe ich nicht. Wenn ich Wärme mit Entropie gleichsetze, habe ich die genannten Probleme. Wenn ich Wärme mit Q gleichsetze, dann habe ich damit doch nur eine Sonderform des Entropiezuwachses beschrieben. Dass Entropie auf andere Weisen wachsen kann, ist dann doch kein konzeptuelles Problem, oder?
Das Problem von Q gleich Wärme ist, dass man geneigt ist zu denken, Wärme sei nun im System. Rein sprachlich: etwas enthält Wärme. Auch das bei Reibung Wärme entsteht, klingt plausibel. All das ist aber falsch (momentan).
Ich würde Wärme auch nicht gleich setzen wollen. Sondern sagen, es gibt zwei Größen, die das Phänomen Wärme (so wie wir es schon weitgehend durch Erfahrung kennen) in der Physik beschreiben, einmal T, die Temperatur als den Grad der Wärme und einmal S, die Entropie als die Menge der Wärme.
Jetzt müsste man schauen, welche Probleme dann überhaupt noch bleiben. Aber natürlich kann und wird es Phänomene geben, die anormal verlaufen.
Starauschek findet KPK-Absolventen sind kompetenter in Wärmelehre als traditionell unterrichtete.
Dazu hat er eine physikalischen Fragebogen benutzt mit Fragen wie “Warum fühlt sich kaltes Metall kälter an als kaltes Plastik” und erhält 33% richtige Antworten von Absolventen des Karlsruher Physikkurs und nur 5 oder 6% richtige Antworten bei konventionell Unterrichteten.
Für mich ist vor allem erstaunlich wie hoch der Prozentsatz der falschen Antworten ist. Das ist schon ein Anzeichen dafür, dass eine Einführung in Wärmelehre von den meisten nicht verstanden wird und ich vermute der Grund dafür liegt darin, dass die meisten Befragten auf ihre Alltagsvorstellungen zurückgreifen, sich also die Alltagsvorstellungen durch die Einführung in die Wärmelehre (Thermodynamik) nicht geändert haben.
Gerade die Beispielfrage zeigt aber das Problem solcher Studien. Warum sich kaltes Metall kälter anfühlt als kaltes Plastik, wird im KPK in der Tat schön anschaulich erklärt; ich sehe aber nicht, dass die Güte der Erklärung direkt mit den Neuerungen des KPK zusammenhinge (mit Wärmeleitfähigkeit allgemein sollte es doch auch gehen?). Insofern ist mir bei solchen Studien immer nicht klar: In welchem Maße testet man da die neuen Konzepte und in welchem Falle, ob das Buch über diese Konzepte hinaus gut oder weniger gut geschrieben ist? Die Konsequenzen, die man ziehen sollte, wären ja jeweils andere…
@Markus Pössel,Stimmt: KPK und konventioneller Physikunterricht scheinen gleich gute, beziehungsweise gleich schlechte Lernerfolge zu zeitigen, wie andere, nicht tendenziöse Verständistests ergeben haben.
Hier muss man auch fragen, warum KPK-Physik einem Aussenstehenden als andere Physik erscheint, obwohl es doch primär um Didaktik, also den Lernerfolg geht. Offenbar dachten die KPK-Erfinder, den Schülern werde falsche Physik gelehrt und deshalb sei bei ihnen der Lernerfolg gering. Mir scheint das eine falsche Hypothese.
Meine These ist folgende:
1) Es ist sehr schwierig in der Sekundarschulstufe ein Verständnis für die Physik zu vermitteln, die später an der Hochschule gelehrt wird – und das fast unabhängig von der Art wie die Physik gelehrt wird. Es gibt zwar immer Schüler, die das schaffen, aber es ist eine Minderheit
2) Es wäre ohne weiteres möglich der Mehrzahl der Schüler auf Sekundarschulstufe zu physikalisch korrekten Überlegungen zu verhelfen solange es nur um qualitative Fragen geht.
Heute ist es so, dass die meisten nach einer Physikeinführung weder Aspekt 1) noch Aspekt 2) verstehen. Das ist schade, da es für die Vermittlung eines qualitativ richtigen Verständnisses vieler physikalischen Phänomenen (Aspekt 2 von oben) gar nicht eines grossen Zeitaufwands bedarf.
Man könnte bei einer Physikeinführung auch rein auf die qualitativen Aspekte fokussieren und erst am Schluss der Einführung eine Mathematisierung vornehmen. Das hätte auch den Vorteil, dass der Schüler die Physik nicht nur als angewandte Mathematik kennenlernen würde sondern dass er den Eindruck mitnähme, man könne Physik ohne höhere Mathematik verstehen. Mit diesem Ansatz könnte man das physikalische Wissen in der Allgemeinbevölkerung verbessern und eventuell sogar die Attraktivität der Physik erhöhen.
Wer innovativ sein will, der sollte in Forschung und Entwicklung arbeiten. Die Schule ist sicher nicht der richtige Ort für Experimente, gegen die Schüler sich nicht wehren können.
Ach und die Didaktiker forschen empirisch wo?
Es geht doch hier um den KPK. Dessen Befürworter haben es 25 Jahre lang nicht geschafft, Erwachsene von ihren Ideen zu überzeugen. Stattdessen haben sie ihre Ideen Kindern vermittelt, die sich dagegen nicht wehren konnten und wollten.
Hi Thilo, für mich wirkt Deine Darstellung erstmal seltsam. Ehrlich gesagt, finde ich das (“Kindern … die sich dagegen nicht wehren konnten”) gegenüber den Kollegen der Didaktik sogar zutiefst ehrabschneidend.
Woher hast Du das: “25 Jahre lang nicht geschafft, Erwachsene von ihren Ideen zu überzeugen” ? Ist das nun durch das DPG Gutachten belegt, oder hast Du Dir weitere Informationen besorgt, auf die Du Dich beziehst? Bitte untermauere es doch ein wenig. Ich meine nicht mal Zitate, aber “das Gutachten zeigt … ” oder “wie ich auch von hier und dort hörte …”
Wenn Du das nicht kannst, dann bitte spare Dir hier solche abwertenden Kommentare gegen Menschen. Ich bitte Dich um Verständnis, dass die nächsten Kommentare in dieser Richtung ohne zumindest einen groben Beleg ich zumindest in Teilen löschen müsste. Ich denke das versteht Du auch und würdest es bei Dir im Blog nicht anders machen. Danke!
Der KPK hat bis heute keinen Eingang in die Hochschulen gefunden. Also haben es die Entwickler (die übrigens in der Forschung tätige Physiker und nicht primär Didaktiker waren: Ruppel und Falk, beide schon lange in Rente bzw. verstorben) offensichtlich nicht geschafft, ihre Fachkollegen von diesen Konzepten zu überzeugen.. Stattdessen wird versucht, den KPK in den Schulen und über diesen Umweg dann auch in den Universitäten zu etablieren.
Das ist auch nicht als persönlicher Angriff auf irgendjemanden gemeint, sondern es geht jenseits der fachlichen Diskussion schon um eine Grundsatzfrage. Sollen an den Schulen nur Dinge gelehrt werden, die außerhalb der Schule als fest etabliertes Wissen gelten? Oder dienen Schulen dazu, neue Menschen zu erziehen, die alles anders und besser machen als es bis jetzt außerhalb der Schulen überall gemacht wird?
Und zu deiner Frage nach Belegen für “25 Jahre lang nicht geschafft”: ein Beleg dafür ist eben, dass der KPK an den Hochschulen (außerhalb des Didaktik-Bereichs) nicht unterrichtet wird. Das andere ist das Abstimmungsergebnis auf der Mitgliederversammlung der Deutschen Physikalischen Gesellschaft (übrigens unter Teilnahme der Fachdidaktiker): die Abstimmung ist mit 160:32 doch recht deutlich ausgefallen. Genügt das als Beleg fürl die fehlende Akzeptanz des Kurses unter Erwachsenen?
Danke, das ist für mich nachvollziehbar.
Das Abstimmungsergebnis wundet mich jetzt nicht, das könnte sehr gut im Fahrwasser des doch beeindruckenden Gutachtens gewesen sein.
Es liegt natürlich nahe, dass sich die Befürworter wirklich an Max Planck erinnert haben, der mal sagte:
“Eine neue wissenschaftliche Wahrheit pflegt sich nicht in der Weise durchzusetzen, daß ihre Gegner überzeugt werden und sich als belehrt erklären, sondern vielmehr dadurch, daß ihre Gegner allmählich aussterben und daß die heranwachsende Generation von vornherein mit der Wahrheit vertraut gemacht ist.”
Ob es wirklich so war, kann ich nicht beurteilen, hielte es aber für plausibel.
Ich bin auch wirklich kein Fan von dem KPK im ganzen und zwar allein, weil ich ihn gar nicht kenne. Alle die sinnvolle Kritik von Dir und Markus Pössel und anderen gehen aber in eine ganz andere Richtung als das Gutachten.
Dass die Bezeichnung von Q mit “Wärme” sehr unglücklich ist, das unterschreibe ich sofort. Meines Erachtens wird der Begriff “Wärme” umgangssprachlich fast synonym mit “Temperatur” verwendet. Viel sinnvoller fände ich “Wärmemenge” oder “Wärmeenergie”. Aber die Entropie als “Wärme” zu bezeichnen, halte ich für komplett verwirrend. Entropie ist ein Maß für die Anzahl an Mikrozuständen pro Makrozustand, sprich, etwas sehr unanschaulich. Das sollte man den Kindern auch klarmachen, dass sie über Entropie wohl noch nicht nachgedacht haben und dass das ein neues Konzept ist, das aber auch nicht so schwer zu verstehen ist: Wirft man 5mal eine Münze, ist das Ergebnis “Kopf und Zahl etwas gleich verteilt (je 2 oder 3 mal)” wahrscheinlicher als “überwiegend Kopf (4 oder 5 mal)” und “überwiegend Zahl (4 oder 5 mal)” -> Der Makrozustand “gleichverteilt” hat eine höhere Entropie als “überwiegend Kopf” und “überwiegend Zahl”.
Wieso sollte man den Schülern erzählen: “Entropie kennt ihr als Wärme” – dann denken sie vielleicht, sie hätten Entropie verstanden, in Wirklichkeit haben sie aber Temperatur oder Wärmeenergie verstanden. Mehr gelernt haben sie doch dadurch nicht.
Die Frage ist ja, ob man auf die mikroskopische Ebene ausweicht. Jetzt denke ich nicht allein an Schulkinder, sondern generell. Übrigens, meinem Sohn habe ich es auch so erklärt, biete ihm aber auch eine makroskopische Erklärung zusätzlich an. Ich halte eine makroskopische Vorstellung auch für wichtig.
Dabei kann man durchaus so vorgehen, dass man sich klar macht, dass für das was wir Wärme nennen, zwei Größen (Menge und Grad, mit je einem eigenen Namen, Entropie und Temperatur) in der Physik existieren.
Letztlich ist das ja nur die Umschreibung, dass man bei der Wärmelehre mit diese beiden Größen anfängt.
Ob mit Wärme zu 70% die Energie und zu 30% die Entropie gemeint ist oder umgekehrt, ist doch völlig irrelevant. Entscheidend ist, dass im KPK die Begriffe so einfach und klar gebildet werden wie sonst in kaum einem andern Physikkurs. Üblicherweise wird der Entropiebegriff derart quer eingeführt, dass niemand draus kommt. Diese geistig vernebelten bilden dann die Speerspitze im Kampf um die kanonisch korrekte Physik (siehe Gutachter der DPG).
Die Thermodynamik, so wie sie heute noch gelehrt wird, hatte vor weit über hundert Jahren ihren Ursprung. Seit sich Albert Einstein mit der Brownschen Bewegung befasst hat, hat sich an der Deutung der stoßkinetischen Gastheorie nichts Wesentliches geändert. Es blieb bei der Translationskinetik, den Freiheitsgraden und dann die Entropie….
Eine ganz andere Sichtweise der Vorgänge zwischen den Atomen und Molekülen ist in einer 5-seitigen pdf.Datei beschrieben, mit dem Titel “Thermodynamik mit Bahndrehimpuls”. Der Link dieser Datei ist auf folgender Webseite zu finden:
http://www.thermodynamik-neu.at
Das Physiker Begriffe kapern und dann so tun, als wären es ihre eigenen, ursprünglichen und präzis definierten Begriffe, während der Rest der Menschheit nur faselt, habe ich auch schon erlebt. Aber dann stolpern sie über die “Anschaulichkeit” der Begriffe und den ganzen semantischen Rattenschwanz, der daran hängt. Vielleicht sollte man nur noch Kunstbegriffe benutzen, bei Quarks geht es ja auch. Also Schnurz und Purps statt Entropie und Wärme 🙂
Mit einer Physik ohne anschauliche Begriffe gäbe es auch keinen gefühlsmässigen, intuitiven Zugang mehr zu physikalischen Phänomenen. Das Gefühl täuscht zwar oft, aber es hilft doch einen physikalischen Vorgang einzuordnen und verschafft einen intuitiven Zugang . Der Karsruher Physikkurs beispielsweise benutzt oft das Strombild. Ein Wärme-, Fluidstrom oder elektrischer Strom oder auch ein Impulsstrom lässt sich auch gefühlsmässig verstehen, wobei man auf die eigenen Erfahrungen mit Flüssikeitsströmen zurückgreifen kann. Das ist für mich ein positiver Zug am KPK wobei diese Analogie beim KPK etwas überstrapaziert ist.
Ohne einen solchen Zugang wäre es noch viel schwieriger Kinder in die Physik einzuführen.
Ich halte die Neudarstellung der Wärmelehre für didaktisch sehr sinnvoll und wäre bereit, meine Schüler die Wärmelehre in dieser Weise zu unterrichten. Alles, was wir alltäglich mit Wärme verbinden, trifft besser auf die Entropie als auf die Wärmeenergie zu. Denn dass die Wärmeenergie nicht von einem kalten zu einem heißen Körper fließt, liegt nicht an der Energie sondern an der Entropie.
Die Gegenargumente, die ich oft höre, zeigen oft ein verbohrtes Festhalten an dem in der Uni Gelernten (“Wärme ist nunmal Energie”). Das Sprengen der alten Zwänge ist das eigentliche Problem. Man stelle sich vor, wir würden das Elektron positiv und das Proton negativ definieren. Dann bräuchten die Schüler nicht mehr zwischen technischer und physikalischer Stromrichtung zu unterscheiden. Aber alle Chemie-, Physik- und Elektrotechnikbücher müssen umgeschreiben werden. Im gleichen Dilemma findet sich die Neudarstellung der Wärmelehre.
Der KPK geht etwas zu weit, weil er der ganzen Physik das Konzept von Energieströmen überstülpt, die für Schüler nicht sichtbar sind.
Volle Zustimmung!
Hier ist eine alternative Wärmetheorie, die ohne Entropie auskommt:
Grundlegende Annahmen:
(die Aussagen beziehen sich alle auf ein ideales Gas, sowie Helium z.B., Temperaturen alle in K)
-bei einer adiabatischen Zustandsänderung wird keine Wärme umgewandelt, auch wenn sich die Temperatur ändert
-das Gas hat einen Volumen-bedingten Wärmespeicher, d.h. bei Volumenverkleinerung wird Wärme aus dem Volumenbedingten Speicher ausgegeben, bei Volumenvegrößerung wird Wärme aufgenommen
-wird ein Gas gedrosselt expandiert (isenthalpe Expansion genannt, Aufbau wie im Versuch von Joul u. Thomson), so entsteht durch Reibung Wärme, die den Wärmeabgang in den Volumen-bedingten Speicher ausgleicht, somit ändert sich die Temperatur nicht (bei idealem Gas)
Herleitung der Formel zur Wärmeberechnung:
1. Schritt: adiabatische Kompression einer Masse Gas mit Temperatur T1 von Volumen V1 auf Volumen V2, Gas bekommt Temperatur T2
2. Schritt: kühlen des Gases auf T1
3. Schritt: adiabatische Expansion auf V1, Gas bekommt Temperatur T3
Folgerung: die Wärme (W1), die durch die Temperaturdifferenz von T2 und T1 definiert wird, muss gleich sein der Wärme (W2), die durch die Temperaturdifferenz von T3 und T1 definiert wird
Wie definiert nun eine Temperaturdifferenz die Wärme, die dadurch aufgenommen/abgegeben wurde?
W1=W2=ln(T2)-ln(T1)=ln(T1)-ln(T3)
Dies kann man mit einem beliebigen Beispiel überprüfen.
Bei einem Gas ist also bei einer Temperaturerhöhung von T1 auf T2 die übertragene Wärme proportional zu ln(T2)-ln(T1) (bei konstantem Volumen)
Anwendung auf den Carnot-Zyklus:
Um eine konkrete Wärme (W) zu berechnen, stellen wir folgende Gleichung auf:
W=a*m*(ln(Th)-ln(Tt)) , m=Masse des Gases , a=Faktor , Th=hohe Temperatur , Tt=tiefe Temperatur
Wendet man diese Theorie auf den Carnot-Zyklus an, so erhält man für die bei der isothermen Kompression abgegebene Wärme (W1) und für die bei der isothermen Expansion aufgenommene Wärme(W2) jeweils:
W1=W2=a*m*2/3*ln(V1/V2) , V1=Anfangsvolumen , V2=Volumen nach isothermer Kompression
Herleitung dazu:
Die bei der isothermen Kompression abgegebene Wärme muss gleich der Wärme sein, die, wenn man statt der isothermen Kompression eine adiabatische Kompression durchführen würde, aus dem Volumen-bedingten speicher abgegeben würde, also die Wärme, die diese Temperaturerhöhung verursachen würde:
W1=a*m*(ln(T1*(V1/V2)^(2/3))-ln(T1))=a*m*2/3*ln(V1/V2) , T1=Aufnahmetemperatur (hoch)
als gesamte Arbeit (A) erhält man:
A=m*Rs*ln(V1/V2)*(T2-T1) , Rs=spez. Gaskonstante , T2=Abgabetemperatur (niedrig)
Aus dem Verhältnis A/W leitet sich folgendes ab:
A=3/2*Rs/a*(T2-T1)*W
Folgerungen:
-die Wärme fließt einfach nur vom hohen zum tiefen Temperturnivo und verrichtet dabei Arbeit, es wird keine Wärme umgewandelt, umgekehrt wird bei einer Wärmepumpe die Wärme tatsächlich einfach nur auf eine höhere Temperatur gepumpt ohne dass gleichzeitig Wärme erschaffen wird
-die gewonnene Arbeit ist proportional zur Wärme und zur Temperaturdifferenz
-nimmt man für T1=0, so ließen sich die Arbeitskosten für die Wärmeerzeugung wiefolgt berechnen:
A=3/2*Rs/a*T*W
(auf die gleiche Gleichung kommt man, wenn man einen Kreisprozess aus gedrosselter Expansion und anschließender isothermen Kompression als Grundlage zur Berechnung nimmt)
-folglich ist Wärme auf höherer Temperatur teurer zu erzeugen als auf niedrigerer
Experimente zur Überprüfung der Theorie:
A) Mischungsversuche:
Man nimmt zwei gleiche Volumen Gas mit jeweils gleicher Masse, deren Temperaturen sich unterscheiden. Nun lässt man beide Massen sich vermischen, sodass die Gasdichte gleich bleibt. Nun misst man die Mischtemperatur T. Wäre die hier vorgestellte Wärmetheorie korrekt, müsste sich die Mischtemperatur T wie folgt berechnen lassen:
T=e^(ln(Th/Tt)/2+ln(Tt))=sqrt(Th*Tt) , Th=Temperatur des wärmeren Gases , Tt=Temperatur des kälteren Gases
Man sollte große Temperaturunterschiede für dieses Experiment wählen, wie z.B. 300K und 700K, da bei zu kleinen Temperaturunterschieden die Mischtemperatur nicht wesentlich von der Temperaturvorhersage der klassischen Vermischungstheorie abweicht.
B) Wärmeerzeugungsversuche:
Man nimmt zwei gleichgroße Behälter gefüllt mit jeweils gleichviel, gleichwarmen Wasser. Dazu gibt man in jeden Behälter einen Tauchsieder. Nun erhitzt man die beiden Flüssigkeiten auf die gleiche Temperatur, wobei die Tauchsieder so betrieben werden, dass der Heizdraht in dem einen Behälter eine wesentlich höhere Temperatur hat als der Heizdraht im anderen Behälter. Wäre die hier vorgestellte Wärmetheorie korrekt, so bräuchte der Tauchsieder mit der geringeren Heizdrahttemperatur wesentlich weniger elektrische Energie als der andere Tauchsieder.
Sonstiges:
Wie weiter oben in dieser Schrift angemerkt, ist die Wärme W, die bei adiabatischer Zustandsänderung aus dem Volumen-bedingten Speicher hinausfließt/hineinfließt, wiefolgt definiert: Beisiel: adiabatische Kompression:
W= a*m*(ln(T1*(V1/V2)^(2/3))-ln(T1))=a*m*2/3*ln(V1/V2) , T1=Anfangstemperatur des Gases
Mit dieser Wärmetheorie lässt sich auch die Temperaturänderung eines Gases bei adiabatischer Zustandsänderung erklären und vorhersagen. Die hierfür zugrundeliegende Gleichung kommt auf das gleiche wie die entsprechende Poissionsche Gleichung heraus: Beispiel: adiabatische Kompression:
T2= e^(ln(T1)+2/3*ln(V1/V2))=T1*(V1/V2)^(2/3)
Auf ein Feedback würde ich mich freuen.
Mit freudlichen Grüßen
js7877787@gmail.com
Vor der Wärmelehre von Clausius war Wärme als etwas unzerstörbares angesehen. Weil nun bei einer Dampfmaschine scheinbar weniger Wärme herauskommt als hereinkommt, musste Clausius annehmen, dass ein Teil der Wärme in Arbeit umgewandelt wird. Doch was, wenn die herauskommende und hineinkommende Wärmen doch gleich sind? Dann müsste die Wärmekapazität mit zunehmender Temperatur abnehmen. Wurde je diese Option überprüft? Hinzu kommt, dass der „Beweis“ für die Umwandelbarkeit von Wärme in Arbeit nur die Umwandelbarkeit von Arbeit in Wärme beweist. In dem Versuch wurde durch Reibungsarbeit Wärme erzeugt. Dies ist jedoch ein unumkehrbarer, irreversibler Prozess. Zudem wäre zu beweisen, dass ein bestimmtes Maß an Arbeit immer gleichviel Wärme erzeugen kann, egal bei welcher Temperatur.
Mir fehlt eine gründliche Widerlegung der früher herrschenden Theorie, dass Wärme unzerstörbar sei. Unzerstörbar heißt, dass es unmöglich ist Wärme in Arbeit zuverwandeln. Die von mir weiter oben vorgestellte Formel würde der mit steigender Temperatur abnehmenden Wärmekapazität Rechnung tragen. Damit bräuchte man keine Entropie mehr, denn Wärme wird nicht umgewandelt, sonder verrichtet nur Arbeit beim Fließen von warm nach kalt. Und noch etwas zu Wärmeerzeugung und ihre Kosten. Es ist bekannt dass Nachtspeicherheizungen wesentlich mehr elektrische Energie benötigen als modernere Elektroheizungen. In Nachtspeicherheizungen herrscht eine hohe Temperatur, der Heizdraht wird also sehr heiß. In moderneren Elektroheizungen ist der Heizdraht jedoch mit Öl oder einem Stein mit guter Wärmekapazität umgeben, somit wird der Heizdraht gekühlt und wird bei Weitem nicht so heiß wie beim Nachtspeicher. Vielleicht ist die niedrigere Wärmeerzeugungstemperatur der Hauptgrund für die Sparsamkeit von modernen Elektroheizungen gegenüber Nachtspeicherheizungen.
Wenn ich mich an mein Schulwissen richtig erinnere, dann beschrieb Rudolf Claudius in seiner Wärmelehre den Energiefluss als gerichtet (z.B. heiß>kalt) – und Ludwig Boltzmann ging davon aus, dass durch die Nutzung dieses Energieflusses Maschinen bewegt werden können.
Statt wilde Theorien zu äußern wäre es eventuell sinnvoll, erst einmal diese Aussagen und deren Bedeutung zu studieren
Verspätet wie die alte Fasnacht möchte ich noch einen Nachtrag anbringen. Auf Linkedin hat ein Fachlehrer für Kältetechnik gezeigt, wie er die Analogie zwischen Förderband und Wärmepumpe benutzt, um letztere zu erklären. Weil ich diese Analogie für didaktisch sinnvoll halte, habe ich ein Video mit einem Verbesserungsvorschlag gemacht. Es geht nicht nur um die Physik, es geht um das Verständnis in der breiten Bevölkerung. Sonst schaffen wir die Energiewende nie.
https://youtu.be/OA-V76BnWZQ