Wie man Antibiotika vor Resistenzen rettet

Es ist noch nicht alles verloren. Wir können zwar nicht verhindern, dass Krankheitserreger gegen die meisten Antibiotika unempfindlich werden, aber die Wirkstoffe sind damit nicht automatisch nutzlos. Die Mechanismen, durch die Bakterien sich gegen Antibiotika wappnen, sind nämlich selbst durch Medikamente verwundbar. Zum Beispiel haben Bakterien, um sich gegen Penicillin und seine Verwandten zu wehren, eine Klasse von Enzymen namens Beta-Lactamasen entwickelt. Die spalten einen für die Wirkung dieser Medikamente wichtigen Molekülteil, so dass das Antibiotikum sein Ziel nicht mehr erreichen kann.
Enthält ein Medikament nun einen neuen Wirkstoff, der seinerseits dieses Resistenzenzym ausschaltet, wirkt das Antibiotikum wieder. Und genau das ist die Idee hinter dem Konzept der Resistenzbrecher: Eine neue Klasse von Molekülen zu entwickeln, die nicht selbst antibakteriell wirkt, sondern den Antibiotika ihre Wirksamkeit zurückgibt.
Antibiotika den Weg freisperren
Das klassische Beispiel für solche Antibiotika-Hilfsstoffe sind tatsächlich die Beta-Lactamase-Inhibitoren, die Penicillin-Antibiotika und den chemisch verwandten Carbapenemen ihre Wirkung zurückgeben. Beta-Lactam-Antibiotika sind seit über 70 Jahren in Gebrauch, so dass Resistenzen durch inaktivierende Enzyme weit verbreitet sind. Die Beta-Lactame stören die Entwicklung der lebenswichtigen Zellwand, so dass die Bakterien bei der Teilung sterben.
Der älteste Inhibitor ist das kleine Molekül Clavulansäure, das zum Beispiel den Wirkstoff Amoxicilin in vielen Fällen wieder nutzbar macht[1]. Penicilline werden seit etwa 30 Jahren zusammen mit Clavulansäure oder den verwandten Molekülen Sulbactam und Tazobactam verabreicht, um Beta-Lactamase-basierte Resistenzen zu umgehen. Man hatte lange gehofft, dass sich gegen die Hemmstoffe keine Resistenzen entwickeln, weil sie selbst nicht antibiotisch wirken. Tatsächlich aber gibt es inzwischen nicht nur gegen Beta-Lactam-Antibiotika Resistenzen, sondern auch gegen jene Moleküle, die die Resistenzen brechen. Das kommt nicht völlig unerwartet, denn der Selektionsdruck ist der gleiche.
Die Adjuvanzien scheinen hier jedoch einen großen Vorteil zu haben: Anders als bei den Antibiotika erweist sich bei dieser Stoffklasse der klassische Ansatz der Wirkstoffsuche, systematisch im Labor hergestellte Moleküle zu testen, als effektiv. Die meisten Beta-Lactamase-Hemmstoffe – Clavulansäure ist eine der Ausnahmen – kommen nicht aus der Natur, sondern aus dem Labor. Und damit ist es auch viel einfacher, einen ineffektiven Hemmstoff gegen ein neues wirksames Molekül auszutauschen. Inzwischen gibt es eine ganze Liste von aussichtsreichen Molekülen, um die Resistenzen gegen Penicilline zu unterlaufen.

Ein ähnlich lohnendes Ziel für Anti-Resistenz-Stoffe sind die Effluxpumpen – Membranmoleküle, die eingeschleuste schädliche Verbindungen wie eben Antibiotika wieder aus der Zelle befördern. Viele Bakterien haben überzählige Kopien der Pumpen-Gene, so dass sie weit mehr davon produzieren als normal und so gegen Antibiotika weniger empfindlich sind. Die Pumpen sind auch einer der Gründe, dass viele antimikrobielle Substanzen gramnegativen Bakterien nichts anhaben können – die gramnegativen Bakterien haben eine zweite Zellmembran außen an der Zellwand, die dafür sorgt, dass kleine Moleküle viel schlechter in die Zelle gelangen. Die restlichen werden von den Effluxpumpen wieder hinausbefördert, so dass sie in der Zelle nie eine für die Bakterien gefährliche Konzentration erreichen. Gramnegative Erreger entwickeln sich derzeit zu einem der größten Probleme der Medizin.
Die Bedeutung der Molekülpumpen
Moleküle, die diese Pumpen blockieren, könnten deswegen nicht nur die von ihnen vermittelten Resistenzen bekämpfen, sondern zusätzlich das Wirkungsspektrum einiger älterer Antibiotika auf gramnegative Keime erweitern. Das wäre ein besonderer Bonus, denn gerade gegen gramnegative Bakterien gibt es allgemein nur wenig wirksame Antibiotika.
Außerdem scheiterten in der Vergangenheit diverse potenzielle neue Antibiotika schlicht daran, dass sie zwar ihr Zielmolekül gut bekämpften, aber viel zu gut von den Effluxpumpen aus der Zelle transportiert werden. Wegen solcher Probleme hat es eine ganze Reihe aussichtsreicher Stoffe nie in klinische Studien geschafft. Diese Moleküle könnten mit wirksamen Pumpenhemmern aus ihrem Dornröschenschlaf erwachen und doch noch ihren Weg in die Klinik finden.
Der bekannteste multiresistente Erreger, dessen Widerstandskraft auf Pumpen basiert, ist auch der älteste: MRSA produziert die NorA-Effluxpumpe, die zum Beispiel Fluorchinolone wie Ciprofloxacin wirksam aus der Zelle transportiert. Außerdem sind Pumpen ein wichtiger Resistenzmechanismus bei den Mycobakterien, zu denen die Erreger von Lepra und Tuberkulose gehören. Entsprechend intensiv wird das Thema beackert; bisher allerdings gibt es anders als bei den Beta-Lactamase-Inhibitoren keine Substanzen, die bereits klinisch zum Einsatz kommen. Seit Jahren sind aussichtsreiche Kandidaten bekannt, bisher ist aber keiner zur Marktreife gebracht worden – warum, weiß ich nicht. Dafür gibt es inzwischen mehrere Antibiotika selbst, die gezielt darauf ausgelegt sind, nicht von den Pumpen transportiert zu werden und so länger in den Zellen zu bleiben.
Spezifisch gegen die gramnegativen Bakterien richten sich einige Moleküle, die die zweite äußere Membran dieser Bakterienklasse durchlässig machen. Die äußere Membran wirkt als effektive Barriere, weil Stoffe sie nur durch spezielle Poren durchqueren können, die weniger als ein Prozent der Membranfläche ausmachen. Das begrenzt die Geschwindigkeit, mit der Antibiotika an ihre Wirkorte gelangen und verbessert so erheblich die Wirksamkeit von Abwehrmechanismen wie zum Beispiel Beta-Lactamasen und Effluxpumpen.
Angriff auf die Membran
Es gibt ein paar Ansätze, diese äußere Schutzhülle mit kleinen Molekülen durchlässiger zu machen. Die äußere Membran der gramnegativen Bakterien hat eine ungewöhnliche Struktur; sie besteht nicht aus normalen Lipiden, sondern aus den Lipopolysacchariden, die negative Ladungen tragen und sich deswegen abstoßen. Positiv geladene, quasi mehrarmige Gegenionen gleichen die Ladung aus und stabilisieren so die Membran. Gleichzeitig machen die Ladungen die Hülle nahezu unüberwindlich für Antibiotika, die speziell darauf ausgerichtet sind, recht unpolar zu sein, um die ungeladene innere Membran zu überbrücken.
Die positiv geladenen Moleküle sind allerdings auch ein guter Angriffspunkt. Man kann sie, so die Hoffnung, mit anderen geladenen Molekülen ersetzen und so die Membran destabilisieren. Es gibt tatsächlich einen ganzen Haufen Moleküle, die das tun und so die Membran durchlässig für alle Arten von größeren Molekülen machen. Einige Antibiotika, die gegen gramnegative Erreger wirken, nutzen dieses Verfahren, um sich selbst in die Zellen zu schleusen.
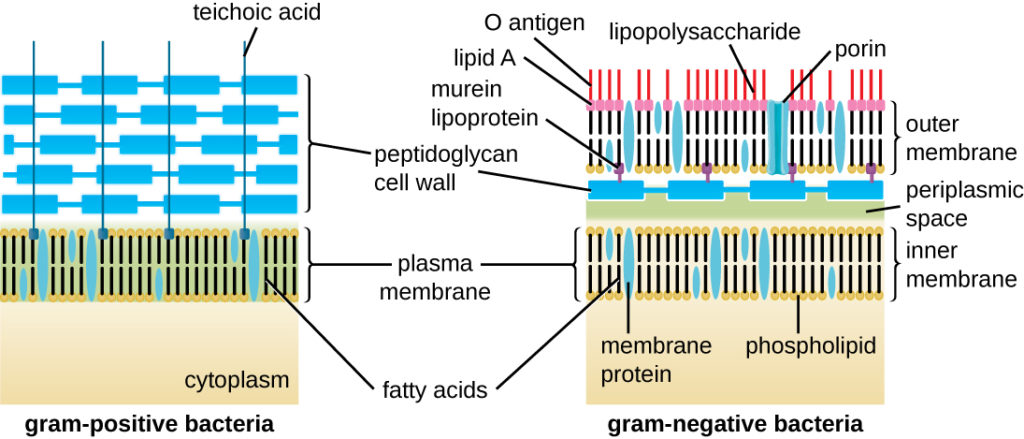
Trotz des großen Potenzials dieses Ansatzes waren die bisherigen Ergebnisse an dieser Front ziemlich ernüchternd. Einige getestete Stoffe sind giftig für Menschen, andere verändern den Fettstoffwechsel menschlicher Zellen. Wieder andere funktionieren in der Praxis nicht so wie anhand ihrer Eigenschaften erwartet, so dass man die Wechselwirkungen zwischen geladenen Molekülen und der Membran vermutlich noch nicht gut genug versteht, um sie für Antibiotika-Adjuvanzien zu nutzen.
Ein weiterer lohnender Angriffspunkt sind die Biofilme – bakterielle Lebensgemeinschaften, die sich auf einer Oberfläche in einen Schleim aus Zuckern und Prozeinen einhüllen und so auf Implantaten und anderen Oberflächen schwer zu bekämpfende Ökosysteme bilden. Einerseits sind Bakterien in solchen Filmen bis zum Tausendfachen unempfindlicher gegenüber Antibiotika, andererseits enthalten die Filme einen kleinen Anteil nicht wachsender, quasi komatöser Bakterien. Diese Persister überstehen Angriffe mit Antibiotika, erwachen anschließend wieder aus ihrem Schlaf und besiedeln den Biofim neu.
Angriffpunkt Signalstoffe
Deswegen sucht man nach Substanzen, die nicht die Bakterien angreifen, sondern ihre Fähigkeit, solche Biofilme zu bilden. Ein aussichtsreicher Ansatz ist dabei, die chemische Kommunikation zwischen den Bakterien zu unterbinden. Signale untereinander, als Quorum Sensing bezeichnet, machen einen ganz wesentlichen Teil der Beziehung zwischen den Bakterienarten der Gemeinschaft aus. Blockiert man die beteiligten Signalstoffe, können sich Biofilme womöglich gar nicht mehr bilden oder lösen sich auf.
Biofilme zu zerstören macht auch nicht nur wegen ihrer Schutzwirkung Sinn, sondern wegen einer historisch gewachsenen Besonderheit der Antibiotika. Die richten sich vor allem gegen frei in Lösung oder auf einem Agar wachsende Kulturen einer einzelnen Bakterienart, wie sie im Labor leicht zu züchten und zu beobachten sind.
Die vielfältigen Gemeinschaften der Biofilme dagegen sind die viel natürlichere Lebensform für Bakterien und damit in der Medizin auch bedeutender. Insofern sind Antibiotika oft quasi am Ziel vorbei entwickelt und wirken nur mehr oder weniger durch Glück auch gegen die natürlichen Gemeinschaften der Krankheitserreger – und vermutlich nicht so gut, wie sie im Idealfall könnten. Es sei denn, es gelingt, die Bakterien aus ihrer Heimstatt herauszureißen.
Einige Ansätze, Biofilme zu stören und zu zerstören, werden derzeit entwickelt. Man weiß zum Beispiel bei manchen Bakterien, welche Signalstoffe am Quorum Sensing beteiligt sind. In einigen Szenarien greift man diese Moleküle chemisch an, so dass sie nicht mehr an die Rezeptoren ihrer Zielbakterien binden. Oder man entwickelt kleine Moleküle, die eben jene Rezeptoren blockieren und die Bakterien quasi taub machen für die Nachrichten ihrer Artgenossen.
Der neue heiße Scheiß?
Eine dritte Variante, nämlich die Herstellung der Signalstoffe zu verhindern, funktioniert zum Beispiel bei jenen Bakterien, die die Pest verursachten. Dort blockiert ein kleines Molekül jenes Enzym, das den Quorum-Sensing-Signalstoff Acylhomoserinlacton produziert. Einige dieser Moleküle haben bereits im Tierversuch gezeigt, dass sie nicht nur Biofilme auflösen, sondern auch die Infektion verringern und dafür sorgen, dass weniger infizierte Tiere sterben.
Das deutet auf eine weitere verwandte Funktion der Signalstoffe. Viele krank machende Bakterien sind überhaupt nur in der Lage, den menschlichen Körper zu besiedeln, weil chemische Signale spezielle Virulenzfaktoren aktivieren, also Moleküle und Zellorgane, die für die Infektion wesentlich sind. Manche Virulenzfaktoren sind Toxine, die Zellen zerstören und Stoffe, die das Immunsystem einschränken, aber auch jene Pili, mit denen zum Beispiel EHEC-Bakterien an die Darmschleimhaut binden und sie angreifen.
Ohne die entscheidenden molekularen Signale dagegen verläuft eine Infektion weit weniger schwer – manchmal findet sie auch gar nicht statt. Eine ganze Reihe Bakterien lebt unter normalen Umständen ganz friedlich in und auf uns. Probleme machen sie erst, wenn irgendein Faktor ihre Virulenzgene aktiviert. Insofern ist die Bedeutung von Signalstoffen als Ziele zukünftiger Therapien weit größer als nur bei der Bildung und Zerstörung von Resistenz- und persistenzfördernden Biofilmen. Diese Forschung steht allerdings erst am Anfang.
Wann solche “Resistenzbrecher” im großen Stil in der Medizin ankommen, und vor allem ob sich mit ihnen das Blatt in Sachen Antibiotikaresistenz wendet, ist im Moment noch ziemlich offen. Forschung und Industrie befassen sich erst seit relativ kurzer Zeit systematisch mit Antibiotika-Hilfsstoffen. Es scheint aber eine gewisse Erwartung in der Luft zu liegen, dass die Antibiotika-Adjuvanzien der neue Heiße Scheiß, oder zumindest ein neuer Hoffnungsträger, im Kampf gegen multiresistente Erreger werden.
.
[1] Fun Fact: Bei meiner letzten Infektion haben die ersten drei Antibiotika nicht gewirkt, die Kombination Amixicilin/Clavulansäure hat es dann gebracht.


Interessant, das macht Hoffnung.
Hab mal hier bisschen geschmökert, werde sicher öfters hier hereinschauen.
Sie erklären sehr gut verständlich. 🙂