Meisterin von Licht und Farbe: Zu Besuch im Atelier der Natur

Für seine Bewerbung um den KlarText-Preis für Wissenschaftskommunikation 2022 in der Kategorie Chemie veranschaulichte Chokri Boumrifak, was er für seine Promotion erforscht hat.
Lichtempfindliche Proteine und deren Farbpigmente ermöglichen es, Zellen mit Licht zu steuern. Dies gelingt über das Pumpen von elektrisch positiver Ladung. Doch wie genau Protein und Pigment miteinander interagieren und was die Pumprichtung bestimmt, ist in vielen Fällen unklar.
Von Emeraldgrün über Cobaltblau bis zu Zinnoberrot – die weltbekannten Gemälde von Claude Monets Seerosen lösen durch ihre Farbenpracht in den meisten Menschen eine große Faszination aus. Dass wir diese Farben wahrnehmen können, haben wir den lichtempfindlichen Proteinen in unseren Augen zu verdanken. Da diese Proteine uns das Sehen ermöglichen und meist eine rosenähnliche Farbe besitzen, werden sie Rhodopsin genannt (griech. rhodon für Rose, opsis für Sehen). Eine Vielzahl von Mikroorganismen nutzen wie wir Menschen ebenfalls Rhodopsine, um auf ihre Umwelt reagieren zu können. Beispielsweise kann die Grünalge Chlamydomonas reinhardtii mit Rhodopsinen zwischen Hell und Dunkel unterscheiden. Das reicht zwar nicht aus, um Monets Werke vollends zu bewundern, aber dadurch kann die Grünalge den optimalen Ort für ihre Photosynthese finden.

Heute sind diese Rhodopsine für Forschende ein nützliches Werkzeug zur Erzeugung von elektrischen Impulsen. Das Licht einer bestimmten Farbe aktiviert die Rhodopsine und diese transportieren elektrisch positiv geladene Teilchen durch die Zellwand. Baut man Rhodopsine künstlich in Nervenzellen ein, so kann man diese mit Licht steuern. Das Besondere daran: Licht ist nicht invasiv und eignet sich nicht nur für Experimente im Reagenzglas, sondern auch in lebenden Organismen. Das haben Forschende bereits an winzigen Würmern sowie größeren, komplexeren Lebewesen wie Mäusen demonstriert. In einer Studie ist es Wissenschaftlern sogar gelungen, mithilfe dieser Rhodopsine die beschädigte Netzhaut eines Menschen teilweise zu reparieren. Das klingt wie Science-Fiction, ist aber heute schon Realität. Da hier Gentechnik eingesetzt wird, nennt sich das Forschungsgebiet Optogenetik.
Inzwischen ist ein breites Spektrum von Rhodopsinen bekannt, die sich in Struktur, Funktion und Farbe unterscheiden. Allein mit der hohen Farbvielfalt der heute bekannten Rhodopsine hätte man die Farbpalette eines Monets locker füllen können. Die Farbe der Rhodopsine stammt von einem Pigment namens Retinal. Das Retinal bestimmt nicht nur die Farbe der Rhodopsine, sondern funktioniert zusätzlich wie eine Antenne, die das Protein lichtempfindlich macht. Daher ist das nahverwandte Molekül Retinol – auch bekannt als Vitamin A – so wichtig fürs Sehen.
Eine große Zahl von Rhodopsinen sind sogenannte Auswärtspumpen, die vor allem kleine positive Ladungen, sogenannte Protonen, aus der Zelle rauspumpen. Nach innen gerichtete Protonenpumpen (Einwärtspumpen) waren aber für eine lange Zeit kaum bekannt. Zahlreiche Versuche aus der Forschung, Auswärtspumpen in eine Einwärtspumpe umzuwandeln, führten zu eher bescheidenen Erfolgen.
An dieser Stelle war es hilfreich, den Blick von Monets Lieblings-Sujet, den Süßgewässern, abzuwenden und auf Salzseen zu richten. Denn dort leben extrem salzliebende Mikroorganismen, die mit Rhodopsinen auf ganz natürliche Weise Protonen in das Zellinnere pumpen können. Da es sich um eine relativ neue Entdeckung handelt und die biologische Funktion den Forschenden noch unbekannt ist, wurde diese Protonenpumpe Xenorhodopsin genannt (griech. xenos für Fremder). Die Xenorhodopsine weisen ähnliche Charakteristika auf wie gewöhnliche Rhodopsine, aber das Pumpverhalten konnte bisher nicht erklärt werden, sodass sich die Frage aufdrängt: Was bestimmt die Pumprichtung dieser Einwärtspumpe?
Das war eine Frage, die mich während meiner Doktorarbeit beschäftigt hatte. Ich selbst bin Chemiker und forschte hauptsächlich an Molekülen, die man mit Licht umwandelt oder aktiviert. Damals befand ich mich gerade im zweiten Jahr meines PhDs, als ich zum ersten Mal vom Xenorhodopsin hörte. Jedoch schien das Xenorhodopsin sich in vielen Punkten den Auswärtspumpen zu ähneln. Warum verhält es sich dann aber so anders?
Da Rhodopsine nicht zufällig in alle Richtungen Protonen pumpen, muss der Pumpvorgang arrangiert sein. Der Pumpvorgang kann mit einer Komposition verglichen werden, in der Retinal, Protein und Proton Teil des Sujets sind. Licht aktiviert das Retinal und das Protein leitet das Pumpen ein. Dann kommen die Protonen ins Spiel, denn diese durchlaufen mehrere Stationen durch das Protein hindurch. Doch was legt fest, in welche Richtung die Protonen sich bewegen? An dieser Stelle fehlt also noch ein wesentliches Element in der Komposition.
In meiner Thesis habe ich versucht nachzuvollziehen wie die Gesamtkomposition für das Xenorhodopsin (kurz: XeR) aussehen könnte und wie die Sujets arrangiert sein müssen, damit Protonen in die Zelle gelangen. Meine Ergebnisse zeigen, dass die Abfolge der einzelnen Schritte essenziell für die Pumprichtung ist. Die Schritte lassen sich unterscheiden in Isomerisierung (I), Switch (S) und Translokation (T).
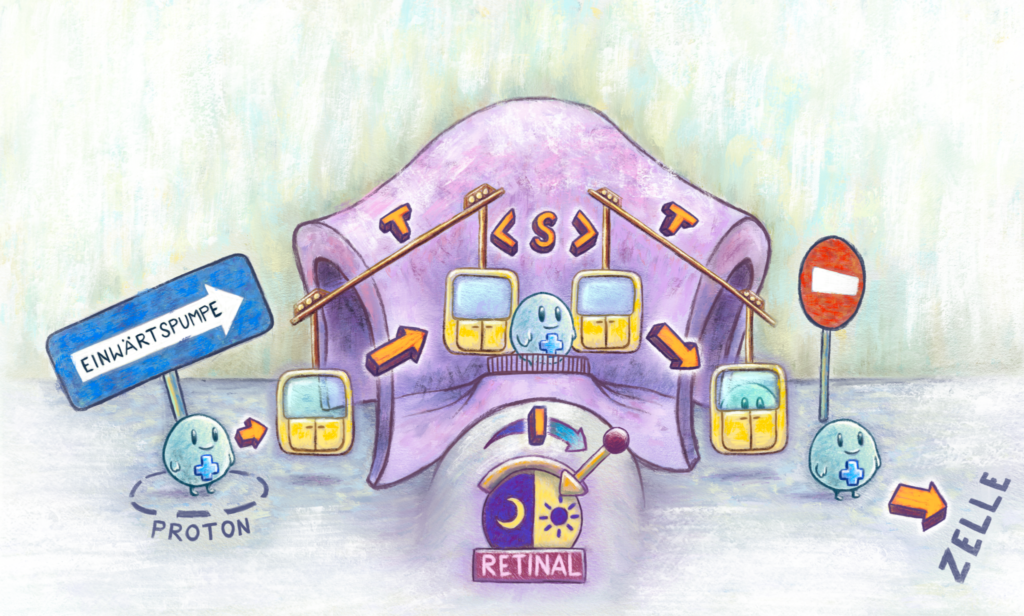
Das Licht knickt das Retinal, was als Isomerisierung bezeichnet wird. Dieser Knick führt dazu, dass auch das Protein aktiv wird. Der Switch beschreibt den Übergang vom Membraneingang zum -ausgang und umgekehrt. Das Proteingerüst kann man sich vorstellen wie eine Seilbahn, bei dem das Höhenhindernis die Membran darstellt. Das geknickte Retinal ist der Hebel, der die Seilbahn einschaltet und die Protonen sind die Fahrgäste. Sobald das Proton in die Seilbahn eingestiegen ist, wird der Eingang unzugänglich und das Proton kann nur noch auf der gegenüberliegenden Seite aussteigen. Die Translokation ist nichts anderes als der Transport eines Protons zwischen zwei Stationen innerhalb des Proteins.
In meinen Messungen habe ich beobachtet, dass bei XeR die Komposition einer IST-Abfolge (Isomerisierung-Switch-Translokation) entspricht und von einer typischen ITS-Abfolge (Isomerisierung-Translokation-Switch) der Auswärtspumpen abweicht. Übersetzt bedeutet dies, dass der Zugang zum Protein “switcht” und die Seilbahn losfährt, bevor das Proton vom Zellinneren einsteigen kann. Die Protonen können also nur außerhalb der Zelle einsteigen und gelangen von dort mit der Seilbahn ins Zellinnere, was letztendlich die Pumprichtung umkehrt.
Diese Beobachtung ist mir mithilfe von spektroskopischen Methoden gelungen. Über die Spektroskopie konnte ich verfolgen, wie sich die Farbe und Stärke des Lichts verändert in einem für das menschliche Auge nicht zu erfassenden Bereich. Jeder einzelne IST-Schritt beeinflusst das Retinal und hat einen Effekt auf die Farbe von XeR, sodass ich die einzelnen Schritte farblich identifizieren und beobachten konnte.

Das IST-Modell selbst existiert bereits seit etwa 30 Jahren. Aber anhand meiner Arbeit konnte ich dieses Modell an der ersten natürlichen Einwärtspumpe anwenden, um die Pumprichtung nachzuvollziehen. Daraus ließen sich weitere Rückschlüsse auf den Pfad der Protonen und dem Verhalten des Proteingerüsts von XeR ziehen. Dieses Wissen trägt aber nicht nur dazu bei, XeR besser zu verstehen, sondern hilft generell Einwärtspumpen zu charakterisieren und für eine gezielte Lichtkontrolle in der Optogenetik anzupassen.
Monet selbst gilt als Meister von Licht und Farbe, hat aber sicher kaum einen Gedanken darüber verschwendet, was die Grünalgen in den Seen, die er malte, mit unserem Sehvermögen gemeinsam haben könnten. Als Impressionist fand Monet aber seine Meisterin in der Natur wieder. Und wie meine Arbeit zeigt, lohnt es sich nicht nur die Kunst der Natur zu bewundern, sondern auch mit dem Licht als Werkzeug einen Blick in ihr Atelier zu werfen und ihre Farbpigmente näher zu studieren.
Chokri Boumrifak studierte Chemie an der Goethe Universität Frankfurt. Dort spezialisierte er sich auf Fotochemie und begann seine Doktorarbeit am Institut für theoretische und physikalische Chemie. Der Forschungsschwerpunkt seiner Thesis lag auf lichtempflichende Membranproteine. In 2022 begann er seine Arbeit als wissenschaftlicher Projektmanager und begleitet seitdem Projekte zu Wasserstoff-Technologien und künstlicher Fotosynthese.

