Matrix aus der Retorte

Und hier nun die letzte Story meines Schwerpunktthemas über Biofilme: Bakterien, die als Kolonie in einer dicken Schleimschicht leben, die auch Matrix genannt wird. Ich habe während meiner Recherchen schnell gelernt, dass Biofilme nicht nur als die berüchtigten Krankenhauskeime schädlich sind, sondern auch ausgesprochen nützlich sein können. Mehr dazu in meinem Beitrag über die “Wunderwelt der Biofilme”. Dass solche Biofilme sogar schon seit langem in der Wasserwirtschaft – beispielsweise für Filter – eingesetzt werden, war mir selbst vorher so noch nicht richtig bewusst, obwohl es sofort nachvollziehbar wird, wenn man sich mit Biofilmen etwas genauer beschäftigt. Das warf dann sofort die Frage auf, wie es mit der biotechnologischen Seite der Biofilm-Forschung steht und welche Ansätze in diesem Gebiet für die Zukunft verfolgt werden. Beim Recherchieren bin ich auf die Aktivitäten an der Bayreuther Uni gestoßen, die diese Forschungen in einem größeren Projektverbund BayBioTech machen. Gesucht werden in diesem Projekt, das die Bayerische Staatsregierung mit zwei Millionen Euro finanziert, ressourcenschonende Schlüsseltechnologien, die Bayern nach eigener Aussage künftig auch als Wirtschaftsstandort zugutekommen sollen. Bei der Auftaktveranstaltung sprach die bayerische Umweltministerin Ulrike Scharf gar vom Mega-Projekt „Rohstoffwende Bayern“.
Im Zentrum: Alternative Herstellungsverfahren für erdölbasierte Kunststoffe, die die moderne Welt von der Plastiktüte bis zu Spielzeug durchdringen.
Die Vision: Zahlreiche Kunststoffe, die heute auf das endliche Erdöl als Rohstoff angewiesen sind, könnten künftig durch maßgeschneiderte Polymere ersetzt werden. Solche Herstellungsverfahren haben bisher den Laborstatus nicht verlassen, sind aber eine attraktive Perspektive, wenn man sich vor Augen hält, dass in der petrochemischen Produktion im Jahr 2016 mit weit über viertausend Millionen Tonnen etwa sieben Prozent des Gesamtverbrauchs an Erdöl benötigt werden. Das typische Merkmal dieser neu erfundenen „Kunststoffe“, die der Fachmann als Biokomposite bezeichnet, ist, dass sie als Ausgangsstoff kein Erdöl mehr benötigen. Die anorganische Chemie wird dabei mit Leben erfüllt, denn Bakterien, eingebettet in eine vorgegebene Polymerstruktur, produzieren dann mit ihren Stoffwechselprozessen feinstrukturierte Vliese und Gewebe als Kunststoff 2.0.
Noch geht es um Grundlagenforschung, denn nicht nur der Chemiker, auch der Biologe weiß heute nicht so ganz genau, wie die biologischen Prozesse in einem solchen bakteriellen Biofilm tatsächlich ablaufen. Das alles ist also längst noch kein großtechnisch brauchbarer Prozess. Immerhin können Forscher die Komplexität in Biofilmen für ihre Experimente im Labor „abstrippen“, indem sie – anders als in natürlich wachsenden Strukturen – nur eine einzige Art von Bakterien einsetzen. Diese in der Natur nicht vorkommende „Reinheit“ erlaubt es, die biotechnologischen Funktionen leichter zu analysieren, andererseits aber auch gezielter zu kontrollieren – und so immer besser zu verstehen. Ziel ist es, ein Modell der Vorgänge in solchen „Single-Species-Biofilmen“ zu entwickeln, aus denen dann im nächsten Schritt auch großtechnische Herstellungsverfahren hervorgehen können. Nichts also, was in wenigen Jahren verfügbar sein wird, eher der große Wurf für die Zukunft.
Die Einsatzmöglichkeiten solcher Biokomposite sind breit. So gelang es vor kurzem dem interdisziplinären Forschungsteam aus Makrochemikern und Biotechnologen an der Uni Bayreuth, erstmals einen synthetisch produzierten Biofilm für die Energietechnik zu entwickeln. Hier werden Biofilme aus spezifischen Mikroorganismen als Katalaysator genutzt, der in einer Brennstoffzelle zwischen Anode und Kathode Strom fließen lässt.
Die Idee biologischer Ersatz-Katalysatoren ist nicht gerade neu. So gab es schon 1911 die erste Veröffentlichung zu einem Vorläufer einer mikrobiellen Brennstoffzelle. M.C. Potter hatte damals beobachtet, dass Mikroorganismen in solchen Biofilmen in der Lage sind, Strom zu erzeugen. 1962 wurde erstmals das moderne Konzept einer mikrobiellen Brennstoffzelle veröffentlicht, damals noch mit Eisenhexacyanoferrat als Mediator, in dem sich unterschiedliche Bakterien zu einem sogenannten Biofilm-Konsortium entwickelten. Seit dem neuen Jahrtausend gibt es Aktivitäten, das Wachstum der Biofilme nicht mehr der Natur – und damit dem Zufall – zu überlassen, sondern im Labor mit den gezüchteten Single-Species-Biofilmen als Ersatz-Katalysator für teures Platin zu experimentieren. Die Wissenschaftler in der Wagnerschen Festspielstadt haben auf dieses Konzept einer einzigen Bakterienart noch eins drauf gesetzt: Erstmals gelang es ihnen, die schleimige Matrix, in der diese Bakterien leben, im Labor gewissermaßen maßzuschneidern. Dieses “Haus” der Kolonie von Mikrowesen, wie es der Pionier der Biofilm-Forschung Curt Flemming gern bezeichnet, wird hier also vom chemischen Architekten entworfen: Er gestaltet dessen Gerüst mittels Polymeren in der Retorte „räumlich“ konkret aus. In diese dreidimensionale Struktur werden dann die Bakterien eingesetzt. So wächst der bakterielle Biofilm also nach steuerbaren Vorgaben und lässt sich auf diese Weise weiter experimentell optimieren. So ist es unter anderem gelungen, den Wirkungsgrad dieser Bio-Brennstoffzelle gegenüber bisherigen Ansätzen im Labor deutlich zu steigern.
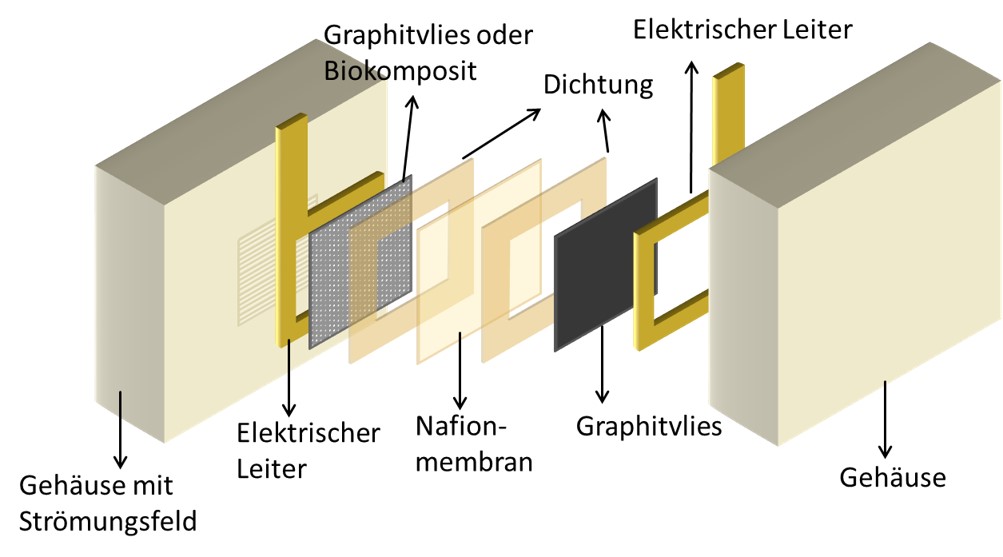
Noch aber, so geben die Experten auch zu, ist hier vieles „Trial and Error“ – die biotechnologische Kunst besteht vor allem darin, die Mikroben in ihrem vorgegebenen Haus auf Dauer am Leben – und damit auch am Wirken – zu halten. Doch die Experimente haben inzwischen ein Stadium erreicht, das die Bayreuther vor kurzem ermutigte, mit ihren Ergebnissen in einer Pressemeldung erstmals an die breite Öffentlichkeit zu treten. Mehr zu dieser innovativen Brennstoffzelle und den Perspektiven der Biokomposite im Allgemeinen gibt es in meinem Talk mit den beiden Wissenschaftlern von der Uni Bayreuth zu erfahren: Andreas Greiner, Professor für Polymerchemie und Lehrstuhlinhaber für makromolekulare Chemie, sowie dem Biotechnologen Dr.-Ing. Patrick Kaiser, der am Lehrstuhl für Bioprozesstechnik mit diesem Thema inzwischen seine Promotion abgeschlossen hat.


Technische Biofilme gehören ins weite Feld der Biotechnologie, wo mit Enzymen, Zellen und Organismen chemische Verbindungen und Diagnoseverfahren hergestellt werden. Hier hat die Menschheit bereits jahrtausendealte Erfahrung etwa mit den Hefen, die für uns alkoholische Getränke oder Joghurt und Käse herstellen. Aktuell ist der Versuch, Mikroorganismen Treibstoffe herstellen zu lassen, Treibstoffe wie sie in Autos mit Verbrennungsmotoren verwendet werden wie Oktan, Butan und andere Kohlenwasserstoffe . Oft werden dabei genetisch veränderte Organismen eingesetzt wie etwa genetisch modifizierte Cyanobakterien, die als Photosyntheseprodukt direkt für Verbrennungsmotoren geeignete Kohlenwasserstoffe herstellen. Allerdings ist hier nicht mit schnellen Erfolgen zu rechnen wie das Beispiel der 2017 in Konkurs gegangenen Firma Joules Unlimited zeigt, welche mit genau solchen genetisch modifizierten Cyanobakterien Treibstoffe in Panelen herstellen lassen wollte, die äusserlich Solarpanelen ähnelten, in denen aber genetisch veränderte Cyanobakterien in wässriger Lösung zirkulierten und dabei mit dem eingestrahlten Sonnenlicht als Energiequelle direkt Treibstoffe herstellten.
Der Einsatz von Biofilmen in der Biotechnologie verspricht in der Tat einige Probleme der Biotechnologie lösen zu können wie etwa das Problem, dass die von den Mikroorganismen hergestellten industriellen Produkte wie Butan (ein „Treibstoff“) , für die Mikroorganismen selbst giftig sind, denn der Biofilm ermöglicht es, das Butan von der Lebensgemeinschaft der Butan herstellenden Mikroorganismen zu trennen. Doch letztlich bedeutet der Einsatz von Biofilmen, also von Membranen hinter denen Bakterien wachsen, auch eine Erhöhung der Komplexität eines an und für sich schon komplexen Systems. Doch langfristig kann der Einsatz von Biofilmen durchaus zum Erfolg führen, denn Komplexität ist beherrschbar, das zeiget uns die Existenz und die Evolution von Lebewesen auf dieser Erde, denn schon Mikroorganismen sind komplex, aber die erst spät in der Evolution enstandenen mehrzelligen Organismen sind es erst recht. Doch sie – die mehrzelligen Organismen – funktionieren, wie uns unter anderem unsere eigene Existenz zeigt.