Die Vorhersage humaner Zoonosen
Etwa zwei Drittel, der für den Menschen schädlichen Krankheitserreger, werden von anderen Wirbeltieren auf den Menschen übertragen. Ebola, Tollwut und die Vogelgrippe sind die bekannten Infektionskrankheiten solchen Ursprungs, die Mikrobiologen Zoonosen nennen.
Bakterien, Viren, Pilze, Parasiten und Prionen können Zoonosen auslösen. Die möglichen Übertragungswege vom Wirbeltier zum Menschen sind unterschiedlich: Eine Zoonose kann über den direkten Kontakt mit einem infizierten Tier, über Milch, Fleisch, Eier oder andere tierische Lebensmittel sowie über sogenannte Vektoren übertragen werden.
Die Rolle von Vektoren bei Zoonosen
Vektoren sind meist Insekten, die den Krankheitserreger vom Wirbeltier auf den Menschen übertragen. Sie sind mit dem Krankheitserreger infiziert, erkranken dabei aber selber nicht. Vektoren rufen die Erkrankung beim Menschen auch nicht selbst hervor. Ein Beispiel für einen Vektor ist eine Stechmücke der Gattung Culex beim West-Nil-Fieber1. Die Mücke überträgt das West-Nil-Virus vom Vogel auf den Menschen, wenn sie den Menschen sticht. Das West Nil-Virus hat sich nach seiner Einschleppung in die USA im Jahr 1999, von Osten nach Westen ausgebreitet und in dortigen Vogelpopulationen endemisch2 etabliert. 2002 und 2003 hat es in jedem Sommer zu mehreren Tausend Fällen von West-Nil-Fieber beim Menschen geführt.
Die lokale Häufigkeit von Zoonosen variiert in Abhängigkeit von klimatischen, ökologischen und sozioökonomischen Faktoren, die der Mensch mehr oder weniger stark beeinflusst. Als 2008 die amerikanische Immobilienblase platzte, hatten sich die Culex-Mücken nördlich von Los Angeles schlagartig in den nicht mehr gereinigten Swimmingpools verlassener Häuser vermehrt. Kalifornische Epidemiologen warnten daher vor einem rasanten Anstieg der Infektionsrate des West-Nil-Virus in der lokalen Bevölkerung. Kein anderes durch Mücken übertragenes Virus ist geografisch weiter verbreitet als das West-Nil-Virus, das auf allen fünf Kontinenten nachgewiesen werden konnte
Zecken sind ein Musterbeispiel dafür, wie sich vektorübertragene Zoonosen durch veränderte klimatische Bedingungen verbreiten können. Zecken übertragen den FSME-Virus von Nagetieren auf den Menschen, der dann an Frühsommer-Meningoenzephalitis (FSME) erkrankt. Erhöhte Temperaturen begünstigen die Entwicklung und Vermehrung der Zecken. Durch mildere Winter und ein erhöhtes Nahrungsangebot erhöht sich die Überlebensrate von Nagetieren, die als Wirtstiere der Zecken gelten. Mittlerweile sind Zecken sogar in den nördlichen Regionen Schwedens und Norwegens zu finden. Und die FSME „wandert“ in Deutschland immer weiter nordwärts. Baden-Württemberg gilt bereits vollständig als Risikogebiet, Bayern zu einem Großteil.
Verstärkerwirte erleichtern den Ausbruch von Zoonosen
Epidemiologen sehen die Ursachen für die Ausbreitung dieser Zoonosen einerseits in dem schnellen Wachstum der Weltbevölkerung und der gestiegenen Mobilität der Menschen, aber auch in Veränderungen in der Nutztierzucht und -haltung. Da außerdem mit der Zunahme der Weltbevölkerung auch der Bedarf an Lebensmitteln steigt, dringt der Mensch bei der Erschließung neuer Anbauflächen in vormals unbesiedelte Gebiete vor, wo er in Kontakt mit Wildtieren kommt, die symptomfreie Träger bislang unerkannter Krankheitserreger sein können.
Sollten bei der zu erwartenden Ausweitung der Viehzucht Rinder, Schweine, Schafe mit solch einem Erreger infiziert werden, besteht die Gefahr, dass sie Verstärkerwirte sind. Verstärkerwirte sind Tiere, in denen sich der Erreger besonders stark vermehrt und dann ausgeschieden wird. Der Verstärkerwirt wird zu einem Bindeglied zwischen dem Reservoirwirt3 (aus dem der Erreger stammt) und dem Menschen, bei dem die Infektion erst bei einer höheren Erregerzahl oder engerem Kontakt Fuß fassen kann. Hier spielt der infektiöse Schwellenwert eine zentrale Rolle: Wenige Erreger genügen, um den Verstärkerwirt zu infizieren, der produziert den Erreger dann aber in so großen Mengen, dass damit die Infektionsschwelle anderer Tiere (hier der Mensch) überwunden werden kann.
Die hohe Produktion begünstigt neben der Bildung einer Quasispezies4 auch das Auftreten von Mutationen (durch Replikationsfehler), die es dem Erreger ermöglichen den Menschen zu infizieren und ihm zu schaden. Eine weitere Gefahr ist die Bildung von Medikamentenresistenzen durch die Mutationen. Nicht alle zoonotischen Erreger brauchen einen Verstärkerwirt, um einen Menschen zu infizieren, aber bei manchen ist das der Fall. Welche sind das und wie funktioniert das Ganze? Um diese beiden Fragen zu beantworten, müssen Bakteriologen, Virologen und Parasitologen mit Zellbiologen und Immunologen zusammenarbeiten.
Eine Fallstudie: Das Lassa-Fieber in Westafrika
Ein Forscherteam um David Redding vom University College London in England entwickelte ein mechanistisches Modell, das Ausbrüche von Zoonosen durch Nutztiere oder Wildtiere, basierend auf Veränderungen des Klimas, des Bevölkerungswachstums und der Landnutzung vorhersagt. Die Epidemiologen testeten ihr Modell am Lassafieber und publizierten ihre Ergebnisse in der Fachzeitschrift Methods in Ecology and Evolution [1].
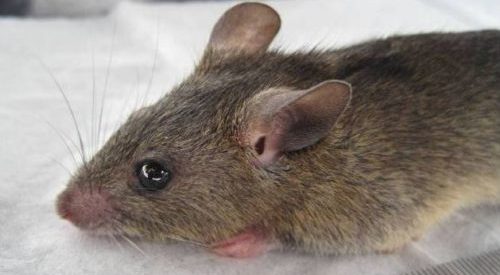
Lassafieber ist in ganz Westafrika endemisch und wird durch das Lassavirus verursacht, das von der Natal-Vielzitzenmaus (Mastomys natalensis) auf Menschen übertragen wird. Das geschieht durch Schmierinfektion über die Ausscheidungen der Mäuse auf anschließend vom Menschen verzehrte Lebensmittel. Epidemiologen schätzen, dass es in Westafrika jedes Jahr etwa zwischen 100.000 bis 300.000 Fälle von Lassafieber gibt, davon verlaufen etwa 70 % subklinisch. Die Sterblichkeitsrate rangiert zwischen 2 % in den Dörfern, 15–16 % in den Krankenhäusern und 30–50 % bei schwangeren Frauen. In Westafrika kam es mehrfach zu Ausbrüchen in Krankenhäusern vor allem in Nigeria, Liberia und Sierra Leone häufig mit Todesfällen unter dem medizinischen Personal.

Das Modell sagt voraus, dass sich die Zahl der Erkrankten aufgrund des Klimawandels und einer wachsenden menschlichen Bevölkerung bis 2070 von 195 125 auf 406 725 verdoppeln wird.
“Unser neuer Ansatz prognostiziert erfolgreich die Ausbrüche einzelner Krankheiten, indem er die Veränderungen in der Verteilung des Wirtes bei Veränderungen der Umwelt mit den Mechanismen der Ausbreitung dieser Krankheit von Tieren auf Menschen kombiniert, was bisher nicht möglich war. Menschen werden wahrscheinlich mit krankheitsübertragenden Tieren in Kontakt kommen, und ihr Risiko, dass das Virus überläuft, wird neben dem Bevölkerungswachstum auch zu einer Ausweitung der westafrikanischen Gebiete führen, die als besonders gefährdet gelten, insbesondere in den westlichen Regionen um Senegal, Guinea, Elfenbeinküste, Ghana und in Zentralnigeria”, sagt der Erstautor, Dr. David Redding.
Die Wissenschaftler nutzten die Standorte von 408 bekannten Lassafieberausbrüchen in Westafrika zwischen 1967-2012 und die Veränderungen in Landnutzung und Ernteerträgen, Temperatur und Niederschlag, Verhalten und Zugang zu Gesundheitsversorgung. Sie identifizierten auch das Wirtstier, eine regionale Subspezies der Natal-Vielzitzenmaus, die das Lassavirus auf den Menschen überträgt, um ihren Standort gegen ökologische Faktoren zu kartieren. Die Forscher prognostizierten mit dem Modell, dass der Klimawandel und das Wachstum der menschlichen Bevölkerung die größten Auswirkungen auf einen zukünftigen Ausbruch des Lassafiebers haben werden, indem sie die Eignung der Region für den Reservoirwirt und auch die Kontaktrate zwischen Reservoirwirt und Mensch erhöhen, während Landnutzungsänderungen nur einen geringen Einfluss auf die Anzahl zukünftiger Ausbrüche haben werden.
Unter Verwendung dieser Informationen zusammen mit Prognosen des Klimawandels, der zukünftigen Bevölkerungsdichte und der Landnutzungsänderungen entwickelten die Forscher dann das Modell. Der Ansatz hat sich bereits bewährt, indem er die Krankheitsmuster des Lassafiebers vorhersagte. Die Forscher sagen, dass das Modell verfeinert werden könnte, um die Übertragung von Zoonosen innerhalb der menschlichen Bevölkerung zu untersuchen, indem die Auswirkungen der Reiseinfrastruktur, der menschlichen Kontaktrate und der Armut einbezogen werden. Das wäre bei den jüngsten Ausbrüchen von Ebola in der Demokratischen Republik Kongo von großem Nutzen.
Fußnoten
1. Bei einer West-Nil-Virus-Infektion entwickelt jeder fünfte Infizierte eine fieberhafte, grippeähnliche Erkrankung, das West-Nil-Fieber. Bei jeder 150. infizierten Person kommt es zu einem schweren Verlauf, etwa zu einer Hirnhaut- oder Gehirnentzündung, die in seltenen Fällen (vor allem bei älteren Patienten) tödlich endet.
2. Endemisch bedeutet hier – im medizinischen Sinne – in bestimmten Gebieten ständig auftretend.
3. Unter Reservoirwirt versteht man hier das Wirbeltier, bei dem der Erreger unter natürlichen Bedingungen vorkommt und sich vermehrt. Je nach Erreger kann der Reservoirwirt ebenfalls erkranken oder asymptomatisch infiziert sein. Vögel z. B. sind Reservoirwirte für das West-Nil-Virus.
4. Unter Quasispezies versteht man in der Virologie das Auftreten verschiedener, gleichzeitig vorhandener Varianten eines ursprünglich infizierenden Virus innerhalb desselben Wirtes. Dabei entstehen die Varianten durch Mutationen des viralen Genoms und Selektion durch die Reaktion des Immunsystems. Durch Entstehung von Quasispezies können diese Viren die Reaktionen des Immunsystems beständig unterlaufen und Resistenzen gegen antivirale Medikamente entwickeln.
5. Hämorrhagisch bedeutet “blutend” oder “Blutungen auslösend”. Hämorrhagisches Fieber ist ein durch eine Virusinfektion ausgelöster Symptomkomplex, der unter anderem Fieber, gastrointestinale Symptome und kapilläre Blutungen (Hämorrhagien) beinhaltet.
Weiterführende Literatur

