Licht an, Nervenzelle aus
BLOG: Die Sankore Schriften

![]() Der gentechnische Einbau von lichtgesteuerten Ionenkanälen und Ionenpumpen in die Membranen von Nervenzellen ermöglicht eine millisekundengenaue reversible Aktivierung und Inaktivierung von spezifischen Nervenzellenpopulationen. So lassen sich funktionelle Zusammenhänge zwischen verschiedenen Gruppen von Neuronen aufspüren, die bisherigen Methoden nicht zugänglich waren.
Der gentechnische Einbau von lichtgesteuerten Ionenkanälen und Ionenpumpen in die Membranen von Nervenzellen ermöglicht eine millisekundengenaue reversible Aktivierung und Inaktivierung von spezifischen Nervenzellenpopulationen. So lassen sich funktionelle Zusammenhänge zwischen verschiedenen Gruppen von Neuronen aufspüren, die bisherigen Methoden nicht zugänglich waren.
Die unerregte Nervenzelle
In einer unerregten menschlichen Nervenzelle besteht eine konstante Spannung (Potenzialdifferenz) zwischen Zellinnerem und Außenmilieu von ca. -70 mV; d.h. im Inneren herrscht ein Überschuss an negativen Ladungen gegenüber außen. Zusätzlich befinden sich in der Nervenzellmembran zahlreiche Ionenkanäle, die bei Aktivierung negativ (Anionen) oder positiv geladene Atome (Kationen) passiv, entlang dem Konzentrationsgradienten, in die Zelle oder aus der Zelle strömen lassen.
Ionenkanäle, die von Acetylcholin oder anderen erregenden Neurotransmittern wie Glutamat geöffnet werden, lassen positiv geladene Natrium-, Kalium- oder Calciumionen durch die Membran treten. Das erzeugt eine Depolarisation, welche die Potenzialdifferenz (den Ladungsunterschied zwischen innen und außen) schlagartig verringert. Hemmende Neurotransmitter wie Glycin lassen negativ geladene Ionen, wie z.B. Chloridionen, in die Zelle strömen, so dass sich die Potenzialdifferenz erhöht (Hyperpolarisation). Die Neurotransmitter dienen dabei praktisch als Schlüssel zur kurzzeitigen Öffnung der richtigen Schleusentore.
Die Entstehung eines Aktionspotenzials
Sinkt die Potenzialdifferenz durch einen Reiz unter einen bestimmten Schwellenwert (ca. -50 mV), dann öffnen sich schlagartig für ca. 1 ms die Natriumkanäle. Na+ – Ionen diffundieren gemäß dem Konzentrationsgefälle (und Ladungsverhältnissen) in das Zellinnere. Dabei kommt es kurzzeitig zu einem Überschuss an positiven Ladungen im Zellinneren gegenüber dem Außenmilieu. Es kommt zu einer Umpolung auf ca. +40 mV innen. Es entsteht ein Aktionspotenzial (AP). Nach einer Millisekunde schließen sich die Natriumkanäle wieder und spannungsgesteuerte Kaliumkanäle öffnen sich. K+ – Ionen diffundieren gemäß dem Konzentrationsgefälle nach außen, bis die frühere Potenzialdifferenz von -70 mV nach kurzzeitiger Hyperpolarisierung wieder erreicht ist.
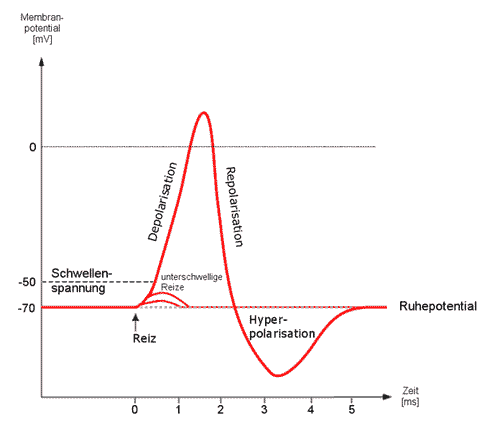
Abb.1: Das Aktionspotenzial einer Nervenzelle Depolarisation: Na+ – Einstrom durch spannungs- und zeitgesteuerte Ionenkanäle Repolarisation: K+ – Ausstrom durch spannungsgesteuerte Ionenkanäle
Methodische Probleme der Neuromodulation
Üblicherweise aktivieren Neurophysiologen Nervenzellen durch Mikroelektroden, über die kurzzeitig elektrische Felder erzeugt werden. In den Nervenzellen in der Umgebung der Elektrode werden dadurch Aktionspotenziale ausgelöst. Obwohl sich diese Aktionspotenziale zeitlich präzise auslösen lassen, ist es kaum möglich, bestimme Nervenzellpopulationen spezifisch zu aktivieren, da nicht nur alle Nervenzellen am Ort der Reizung aktiviert werden, sondern auch die Axone von weit entfernt liegenden Neuronen, die den Reizort passieren. Darüber hinaus ist es für funktionelle Untersuchungen ebenso interessant, Nervenzellen spezifisch zu inaktivieren und dies ist durch elektrische Reizung nur schwer möglich.
Um lokal Nervenzellen zu inaktivieren werden daher hemmende Neurotransmitter wie Glycin eingesetzt. Allerdings lässt sich die räumliche Ausdehnung der Freisetzung kaum gezielt kontrollieren und es werden wie bei der elektrischen Reizung unspezifisch alle Nervenzellen am Ort der Transmitterfreisetzung beeinflusst.
Neuromodulation durch Licht
Die Forscher Feng Zhang und Li-Ping Wang der Universität Stanford fanden einen eleganten Weg um die oben beschriebenen methodischen Probleme zu lösen: Mit gentechnischen Methoden bauten sie lichtgesteuerte Ionenkanäle und Ionenpumpen in Nervenzellen ein [1]. Sie verwendeten das Channelrhodopsin-2 (ChR2), ein Kationenkanal aus der Grünalge Chlamydomonas reinhardtii, der durch blaues Licht (Wellenlänge 460 nm) aktiviert wird und das Halorhodopsin aus dem Archaebakterium Natronomonas pharaonis (NpHR), das als Ionenpumpe Chlorid in das Zellinnere transportiert und durch gelbes Licht (580 nm) aktiviert wird.
Wird ChR2 in Nervenzellen exprimiert, führt Belichtung mit blauem Licht zu einem schnellen Einstrom von Natrium- und Calciumionen und damit zur Auslösung eines Aktionspotenzials. Durch Expression des NpHR ist es möglich Nervenzellen gezielt zu inaktivieren und die Ausbildung von Aktionspotenzialen zu unterdrücken. Belichtung mit gelbem Licht löst einen Chlorideinstrom in der Nervenzelle aus, der dazu führt das sich die Potenzialdifferenz zwischen Zellinnerem und Außenmilieu vergrößert.
Die unterschiedlichen Absorptionsspektren der beiden Proteine, die so gut wie keine Überlappung aufweisen, ermöglicht es, durch Belichtung mit Wellenlängen der jeweiligen Absorptionsmaxima Neurone selbst dann selektiv zu aktivieren und zu inaktivieren, wenn sie beide Proteine exprimieren.
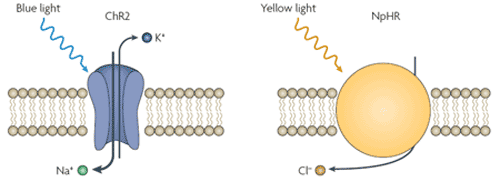
Abb.2: Channelrhodopsin-2 (ChR2) und Halorhodopsin (NpHR)
Lichtgesteuerte Neuromodulation in vitro
Die Wissenschaftler fusionierten das NpHR mit einem fluoreszierenden Protein (EYFP) und schleusten das NpHR-Gen mit einem viralen Vektor in kultivierte Hippocampus-Nervenzellen ein. Sie konnten nun mit gelbem Licht einzelne Aktionspotenziale ebenso wie eine ganze Salve von Spikes unterbinden. In einem nächsten Schritt verknüpften sie Channelrhodopsin-2 mit einer rot fluoreszierenden Protein-Variante (mCherry) und koexprimierten den Kanal und die Pumpe in denselben Hippocampus-Neuronen. Tatsächlich war es nun möglich, das Membranpotenzial in ein und demselben Neuron in beide Richtungen zu verändern: Blaue Lichtpulse lösten durch Aktivierung von ChR2 Aktionspotenziale aus, während gelbe Lichtpulse durch Aktivierung von NpHR die Aktionspotenziale löschten.
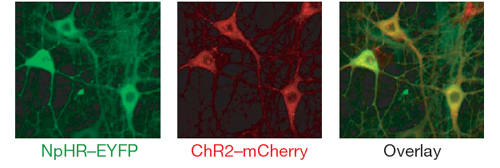
Abb.3: Koexpression von NpHR und ChR2 in derselben Nervenzelle Zellkultur von Hippocampusneuronen, die NpHR-EYFP unter der Kontrolle des EF1 alpha-Promotors und ChR2-mCherry unter der Kontrolle des Synapsin I-Promotors exprimieren
Damit lassen sich nun natürliche reizkorrelierte Aktionspotenziale künstlich generieren und wiederholen. Da die Wirkung der erregend oder hemmend wirkenden Lichtstrahlen von deren Intensität abhängt, lassen sich die erzielten Effekte quantitativ regulieren, so dass sich beispielsweise überschwellige Erregungen durch geeignet gewählte gelbe Lichtpulse auf unterschwelliges Niveau begrenzen lassen.
Wird ChR2 mit einem Fluoreszenzlabel markiert, können durch Licht angeregte Axone und Synapsen im intakten Gehirngewebe identifiziert werden [3]. Diese Technik lässt sich zur Aufklärung der mokularen Ereignisse während der Induktion synaptischer Plastizität einsetzen [4]. Mit Hilfe von ChR2 wurden weitreichende neuronale Bahnen im Gehirn kartiert [5].
Mittlerweile gibt es lichtgetriebene Ionenpumpen, die sich besser zur Inaktivierung von Nervenzellen eignen, weil sie präziser und schneller als NpHR arbeiten [2]. Diese Ionenpumpen transportieren Kationen aus dem Zellinneren nach draußen. Es handelt sich um Arch aus Halorubrum sodomense und Mac aus Leptosphaeria maculans, die spezifisch durch gelbes bzw. blaues Licht aktiviert werden. Das erlaubt den Forscher verschiedene Neuronenpopulationen mit unterschiedlichem Licht zu inaktivieren.
Lichtgesteuerte Neuromodulation in vivo
Eine wichtige Frage war, ob mit diesem System auch das Verhalten eines Tieres in vivo kontrolliert werden kann. Dass sich das Verhalten transgener Tiere, die ChR2 in einem Anteil ihrer Neuronen exprimieren, durch intensive Beleuchtung mit Blaulicht berührungslos kontrollieren lässt, wurde bereits für Nematoden, Taufliegen, Zebrafisch und Mäuse gezeigt [6, 7, 8]. Wird NpHR in Hautmuskelzellen von Caenorhabditis elegans exprimiert, so führte Lichtaktivierung zum unmittelbaren Stopp (innerhalb von 150 Millisekunden) der Schwimmbewegungen. Nach Beendigung des Lichtreizes kehrte der kleine Fadenwurm zu seinem natürlichen Schwimmverhalten zurück. Für die zellspezifische Expression von NpHR wurde der Promotor des Myosins genutzt, das nur in Muskelzellen exprimiert wird. Zur besseren Sichtbarkeit war NpHR mit einem blau fluoreszierenden Protein (ECFP) gekoppelt. Zellen, die NpHR-ECFP exprimieren sind an ihrer Blaufärbung zu erkennen.
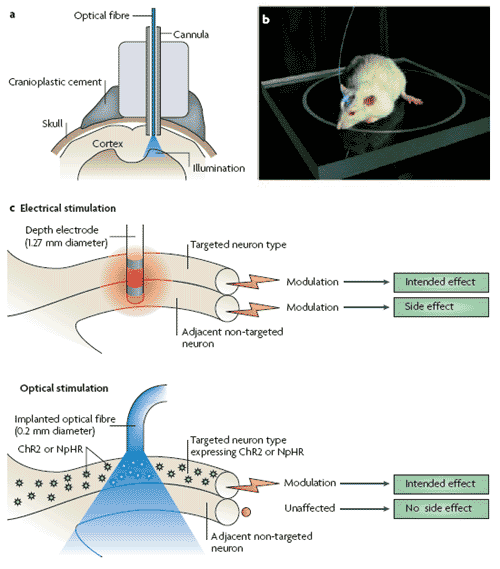
Abb.4: Lichtgesteuerte Neuromodulation im Mausmodell a Eine Kanüle wird auf den Kopf der Maus implantiert um die Lichtleitfaser auf eine bestimmte Hirnregion zu lenken. b Die Lichtleitfaser ist mit einer Laserdiode verbunden die blaues oder gelbes Licht in das Gehirn strahlt c Zelltypspezifische Expression des Transgens erlaubt die lichtgesteuerte Neuromodulation von Nervenzellen ohne Nebeneffekte im Gegensatz zur elektrischen Neuromodulation.
Regionale und zelltypspezifische Expression des Transgens im Gehirn
Das Transgen wird mit Hilfe von Stereotaxie und einem viralen Vektor, der entweder auf einem Lentivirus oder einem Adeno-assoziierten Virus (AAV) basiert, in die Nervenzellen einer bestimmten Hirnregion gebracht. Die zelltypspezifische Expression des Transgens wird gewährleistet, indem das Transgen unter die Kontrolle eines zelltypspezifischen Promotors gebracht wird. Lentirviren werden in das Genom der Nervenzelle eingebaut. Die AAV sind von einem Adenovirus abhängig (daher "adeno"-assoziierte Viren). Das Helfervirus liefert Proliferationsgene. Ohne die Anwesenheit von Adenoviren integriert AAV beim Menschen auf Chromosom 19.
Mit den lichtschaltbaren Proteinen haben die Neurobiologen ein sehr vielseitig anwendbares Werkzeug in der Hand, mit dem sowohl in neuronalen Zellkulturen als auch in transgenen Tieren völlig neuartige Untersuchungen durchgeführt werden können.
doi:10.1038/nature05744 Zhang, F., Wang, L., Brauner, M., Liewald, J., Kay, K., Watzke, N., Wood, P., Bamberg, E., Nagel, G., Gottschalk, A., & Deisseroth, K. (2007). Multimodal fast optical interrogation of neural circuitry Nature, 446 (7136), 633-639 DOI: 10.1038/nature05744
Literatur
Bildnachweis
Abb.1: Das Aktionspotenzial einer Nervenzelle
Wikipedia
Abb.2: Halorhodopsin (NpHR) und Channelrhodopsin-2 (ChR2)
Figur 1
Abb.3: Koexpression von NpHR und ChR2 in derselben Nervenzelle
Figur 2
Abb.4: Lichtgesteuerte Neuromodulation im Mausmodell
Figur 2

