Antifaltencreme für Zellen

 Dieser Text entstand im Rahmen des Klaus-Tschira-Preises für verständliche Wissenschaft. Hier schreiben Promovierte über ihre Doktorarbeit. Nur die Gewinnertexte wurden in Bild der Wissenschaft veröffentlicht. Es sind aber noch viele weitere hervorragende Texte darunter gewesen. Einigen von diesen wird in den Scilogs nun auch ein Platz in Form von Gastbeiträgen eingeräumt. Initiiert von Anna Müllner, die selbst am Preis teilnahm, hier bei den Scilogs bloggt und es schade fand, dass so viele spannende Geschichten über Wissenschaft nicht den Weg in die Öffentlichkeit fanden. Die Artikel findet ihr gesammelt hier, sie werden hintereinander veröffentlicht.
Dieser Text entstand im Rahmen des Klaus-Tschira-Preises für verständliche Wissenschaft. Hier schreiben Promovierte über ihre Doktorarbeit. Nur die Gewinnertexte wurden in Bild der Wissenschaft veröffentlicht. Es sind aber noch viele weitere hervorragende Texte darunter gewesen. Einigen von diesen wird in den Scilogs nun auch ein Platz in Form von Gastbeiträgen eingeräumt. Initiiert von Anna Müllner, die selbst am Preis teilnahm, hier bei den Scilogs bloggt und es schade fand, dass so viele spannende Geschichten über Wissenschaft nicht den Weg in die Öffentlichkeit fanden. Die Artikel findet ihr gesammelt hier, sie werden hintereinander veröffentlicht.Ewig jung zu sein, diesen Traum hat die Menschheit bereits seit Jahrtausenden. Nicht zu altern – und vor allem die Gebrechen des Alters vermeiden – ist vielen von uns ein Wunsch. Denn mit dem Alter kommt die Krankheit. Aber ist es wirklich nur der Zahn der Zeit der da an uns nagt? Der unser Gesicht in Falten wirft, der die Gelenke knirschen lässt und uns einen Stammplatz im Wartezimmer des Arztes beschert? Oder sind dies wirkliche biologische Prozesse?
Sie werden sich denken können, wenn ich mich als Biologin mit dem Thema Alterung beschäftigt habe, dann ist die Alterung wohl etwas Biologisches. Nicht nur das: Das wir altern werden steht bereits mit unserer Geburt fest. Der Prozess lässt sich nicht aufhalten. Noch nicht. Denn die Mechanismen, die uns während unserer Jugend so schützt, damit wir alt genug werden um uns zu vermehren, wird uns später einmal zum Verhängnis.
Aber warum werden wir nun immer älter? Es gibt einige Theorien, mit einer davon habe ich mich beschäftigt. Und sie birgt großes Potential, die Alterung der Körpers zu verlangsamen.
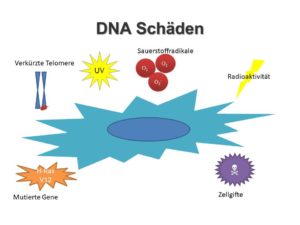
Sehen Sie, jeden Tag den wir auf der Welt verbringen nimmt unsere DNA, unser Erbgut, das tief verborgen in jeder unserer Zellen sitzt, Schaden. Diese DNA ist der Bauplan für alles, was in unserem Körper passiert, auf ihr ist das Rezept des Lebens gespeichert. Und sie wird bedroht, immer wieder aufs Neue. Unsere DNA ist empfindlich, sie mag kein Sonnenlicht, sie mag keine radioaktive Strahlung, auch Zellgifte können dazu führen, dass sie sogenannte Brüche erleidet. Die filigrane Doppelhelix droht immer wieder zu Reißen.
Ja, denken Sie nun vielleicht, dann sollten wir uns doch am Besten von allen Schadensquellen entfernen. Sonnenlicht vermeiden mag da noch das Einfachste sein. Denn wir sind ganz natürlicherweise von verschiedenen Arten von Strahlung umgeben. Auch Zellgifte nehmen wir immer wieder auf, denn schon simples Atmen führt dazu, dass sich in unseren Zellen reaktiver Sauerstoff bildet, welcher die DNA bedroht. Aber sicherlich können wir der Alterung ein Schnippchen schlagen, wenn wir einfach aufhören zu atmen, nur haben wir dann nicht viel davon.
Was ist Seneszenz?
Was also können wir tun? Wir können uns den DNA-Schaden der verursacht wird genauer ansehen. Es gibt dort verschiedene Arten. Die gefährlichste ist der DNA-Doppelstrangbruch, wenn beide Rückgrate der Helix durchtrennt werden. Diese Art von DNA-Schaden entsteht etwa einmal täglich pro Zelle. Freie DNA-Enden lösen in unseren Zellen die Alarmstufe Rot aus. Blitzschnell finden sich einige der Biobausteine der Zelle, die Proteine, an diesen Stellen ein und halten die zwei Enden zusammen. Sie aktivieren weitere Proteine welche nun dafür sorgen, dass die Zelle entsprechend reagiert. Sie kann den Schaden reparieren. Ist er jedoch zu groß kann sie auch den Selbstmord, die Apoptose, einleiten. Eine weitere Option für die Zelle ist es, die Zellteilung einzustellen.

Eine Zelle die sich nicht mehr teilt – und auch nie mehr teilen wird – nennt man seneszent. ‚Senescere ‘ ist das lateinische Wort für „altern“, was ein wenig den Spannungsbogen dieses Berichtes schmälert. Diese seneszenten Zellen haben nämlich tatsächlich etwas mit der Alterung zu tun. Zunächst einmal ist die Seneszenz aber auch nur ein Weg der Zelle, den Körper vor sich selbst zu schützen. Durch DNA-Schaden können Erbgutveränderungen auftreten, welche später zu Krebs führen können. Wird die Zelle seneszent kann sie sich nie mehr teilen und so die Erbgutveränderungen nicht weitergeben. Dadurch, dass die Zelle trotzdem lebendig bleibt, kann sie den Körper auch weiter schützen, indem sie Botenstoffe an ihre Umgebung aussendet. Damit signalisiert sie, dass es gerade ein Problem gibt. Sie verändert ihre Umgebung und kann mit diesen Botenstoffen auch die Zellen in ihrer Umgebung in die Seneszenz zwingen. Außerdem locken sie damit Immunzellen an. Und genau hier liegt des Pudels Kern.
Eigentlich sollen diese Botenstoffe, sogenannte Signalmoleküle, die Immunzellen, anlocken, damit die seneszenten Zellen von ihnen eliminiert werden. Das funktioniert aber nicht immer. Da mit der Zeit immer mehr seneszente Zellen entstehen kommt das Immunsystem nicht mehr hinterher. Die seneszenten Zellen häufen sich an und senden weiterhin ihre Signalmoleküle aus. Diese lösen in den Geweben Veränderungen aus, die wir aus der Alterung kennen. Viele Krankheiten, wie Rheuma, Arthrose, Arteriosklerose und auch Krebs werden durch andauernde, chronische Entzündung begünstigt. Und so könnte es sein, dass die Anhäufung seneszenter Zellen die Alterung und altersbedingte Krankheiten begünstigen.
Und tatsächlich: Versuche mit genveränderten Mäusen konnten zeigen, dass die Eliminierung der seneszenten Zellen dazu führte, dass die Tiere weniger alterten. Die Lebensdauer wurde dadurch allerdings nicht erhöht. Bestimmte Chemotherapeutika zeigten bei Mäusen ähnliche Ergebnisse. Besser wäre es jedoch, die seneszenten Zellen gar nicht erst entstehen zu lassen.
Bemerkt eine Zelle DNA-Schaden, so sind sofort bestimmte Proteine zur Stelle, die sich darum kümmern. Aber wie genau wird die Entscheidung gefällt, ob eine Zelle nun zum Selbstmörder wird oder als seneszente Zombie-Zelle weiterhin ihr Dasein fristet? Es scheint nicht so sehr daran zu liegen, wieviel Schaden die Zellen erhalten haben – aber was könnte es dann sein?
Der molekularen Überboss
Ich habe mich auf die molekulare Suche begeben. Dazu habe ich mir die Proteine angesehen, welche im Falle eines DNA-Doppelstrangbruchs aktiviert werden. Der Verdächtige heißt in diesem Fall p53. Dieses Protein ist der mächtige Überboss, der über Leben, Tod und Seneszenz der Zelle entscheidet. Aber p53 kann eigentlich nur eines: Das Abschreiben von Genen aktivieren, deren Produkte (die Proteine) die Zelle in die eine oder andere Richtung lenken. Das tut p53 aufgrund von Informationen, die ihm seine Handlanger bringen. Es sind kleine Veränderungen von anderen Proteinen. Dem Protein HIPK2 kommt eine besondere Aufgabe zu. Es legt bei p53 den Todesschalter um. p53 leitet daraufhin den Selbstmord ein.
Folglich müsste bei der Seneszenz etwas in der Zelle verhindern, dass HIPK2 diesen Schalter bedienen kann. Nun, wider Erwarten tut sie dies nicht. HIPK2 ist in der Zelle präsent wie je zuvor und scheint auch den Todesschalter von p53 umzulegen. Doch die Zellen sterben nicht – sie leben weiter, aber eben seneszent. Also beschloss ich herauszufinden, was passiert wenn HIPK2 nicht da ist. Durch ein neuartiges Verfahren, CRISPR/Cas9, zerstörte ich das Gen für HIPK2. Ohne den Bauplan im Gen konnten die Zellen das Protein HIPK2 nicht mehr herstellen.
Gen für HIPK2. Ohne den Bauplan im Gen konnten die Zellen das Protein HIPK2 nicht mehr herstellen.
Die Versuche mit Zellen ohne HIPK2 gaben uns nur weitere Rätsel auf. Die Zellen schienen nun, den Selbstmord der Seneszenz vorzuziehen. Ganz gegen unsere Erwartungen. Auf der Suche nach Gründen fand ich heraus, dass HIPK2 Einfluss auf ein weiteres Protein haben kann, das die Zellteilung anhält. So kann HIPK2 eventuell einen Keil in das Lebensrad der Zelle treiben.
Alles nicht so einfach – oder doch?
Sicherlich ist damit der Jungbrunnen noch nicht entdeckt. Wie so oft in der Grundlagenforschung ist dies ein kleines Puzzleteilchen in einem großen Ganzen. Noch weiß man nicht so viel über die seneszenten Zellen und so tappen wir noch oft im Dunkeln. Aber es gibt interessante Ansatzpunkte. Denn Prozesse innerhalb der Zelle sind hochdynamisch. Proteine schwanken sehr häufig und schnell zwischen aktiven und inaktiven Stadien, da sie sich immer wieder gegenseitig reaktivieren. Diese Rückkopplungsschleifen geben unseren Zellen immer wieder erneut die Möglichkeit die Begebenheiten zu analysieren, um keine verfrühten Entscheidungen zu treffen. Nimmt man einen einzelnen Spieler wie HIPK2 aus diesen Schleifen heraus, verändern sie sich. Unsere Zellen könnten so verfrühte oder verspätete Entscheidungen treffen. Und immerhin geht es für sie um Leben und Tod!
Während meine Grundlagenforschung noch nicht viele Einsatzmöglichkeiten hat, haben es die bisherigen Erkenntnisse über die Seneszenz durchaus. So fand man bei der Untersuchung von jungen Menschen, die erfolgreich eine Krebstherapie durchlaufen hatten, sehr viele seneszente Zellen. Diese Menschen litten sehr häufig unter verfrühten Alterungssymptomen wie Arthrose und Müdigkeit. Es könnte schon bald möglich sein, die seneszenten Zellen mit einer speziellen Therapie abzutöten und ihnen so ein normales Leben ermöglichen. Und wer weiß, vielleicht gehen wir in einigen Jahren selbst zu einer Kur und lassen unseren Körper von den seneszenten Zellen befreien und müssen keine Alterungskrankheiten mehr befürchten.



Pingback:KlarText!-Preis: Die Klaus-Tschira-Stiftung vergibt einen Preis für verständliche Wissenschaft » 1ife5cience » SciLogs - Wissenschaftsblogs
Kann Quercetin seneszente Zellen in alternden Säugetieren in vivo eliminieren?