Ein trojanisches Pferd aus Zucker

Für seine Bewerbung um den KlarText-Preis für Wissenschaftskommunikation 2020 in der Kategorie Chemie veranschaulichte Benjamin Breitenbach, was er in seiner Promotion erforscht hat.
Selbstfaltende Nanotransporter könnten einen Umbruch in der Krebstherapie bewirken. Eine alte Idee inspiriert die Entwicklung einer Technologie, die zuletzt auch für den Erfolg der prominenten mRNA Wirkstoffe unverzichtbar war.
Was haben Viren und das trojanische Pferd aus Homers Ilias gemeinsam? Beide verbergen, schützen und transportieren eine wichtige Fracht in ihrem Inneren: Ähnlich wie Odysseus seine Krieger im Bauch des hölzernen Pferdes unerkannt in die Stadt Troja schmuggelte, nutzen Viren eine Schutzhülle, um ihre empfindliche Erbinformation in Wirtszellen zu schleusen. Diese Art der Verpackung erlaubt es, dass die zerbrechliche Fracht während der Reise durch den Körper nicht schon vor Ankunft am Zielgewebe von Enzymen erkannt, abgebaut und anschließend ausgeschieden wird.
In der modernen Chemotherapie kann genau dieses Prinzip zur Lösung eines bisher schwerwiegenden Problems beitragen: Viele neue Medikamente zeigen zwar eine gute tumorspezifische Wirkung, werden im Körper jedoch schnell abgebaut, zu früh ausgeschieden, oder sind schwierig zu verabreichen. Um dennoch eine wirksame Konzentration im Blut zu erreichen sind hohe Dosen nötig. Weil der Wirkstoff sich dabei im ganzen Körper verteilt, kommt es zu starken Nebenwirkungen und zur Schädigung von gesunden Zellen.
Zusammen mit meinen Kollegen forschte ich daher an Materialien für den Bau eines trojanischen Pferdes für Chemotherapeutika. Die Idee ist einfach: der Wirkstoff zirkuliert in seinem Transporter so lange inaktiv und unerkannt durch den Körper, bis er am Tumor ankommt und freigesetzt seine Wirkung entfaltet. Damit verringern wir sowohl den frühzeitigen Abbau des Medikaments als auch ungewollte Nebenwirkungen auf gesunde Zellen. Zudem nutzen wir aus, dass einige Tumore im Vergleich zu gesundem Gewebe durch ihr schnelles Wachstum schwammartig aufgebaut sind. Kleine Partikel gelangen mit dem Blutkreislauf durch die Öffnungen im Gewebe und reichern sich hier vermehrt an, ähnlich wie Sand der sich im Seitenarm eines Flusses ablagert.
Die Grundidee dazu hatte der deutsche Arzt, Chemiker und Nobelpreisträger Paul Ehrlich bereits um 1900. Ehrlich postulierte „wir müssen chemisch zielen lernen“ und entwarf das Konzept einer magischen Gewehrkugel, die den Krankheitserreger tötet, dem Menschen aber nicht schadet. Seine Idee wurde über die folgenden Jahrzehnte zum generellen Konzept eines Wirkstofftransporters weiterentwickelt, der seine Fracht nur am gewünschten Zielort im Körper absetzt.
Um durch die poröse Gefäßwand des Tumors zu gelangen, darf unser trojanisches Pferd allerdings nicht größer sein als wenige hundert Nanometer. Das ist ungefähr fünfzig mal kleiner als ein rotes Blutkörperchen, oder fünfhundert mal schmaler als der Durchmesser eines menschlichen Haares. Aber wie baut man eine so winzige Kapsel?
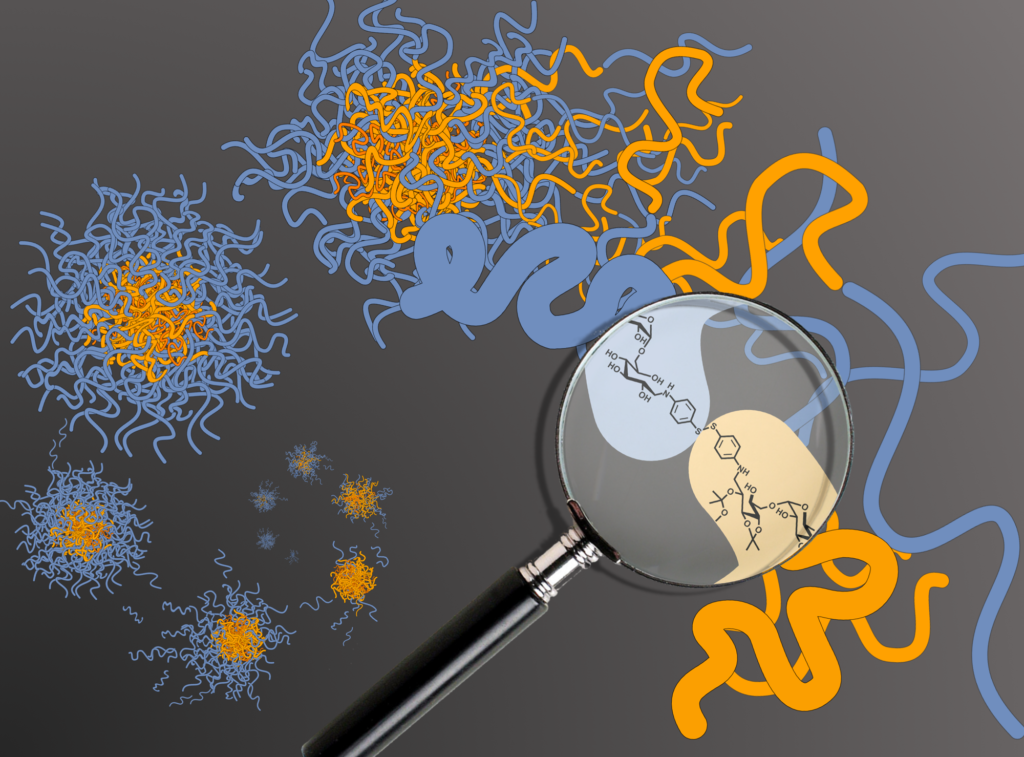
Bisherige Nanotransporter nutzen amphiphile Moleküle wie natürlich vorkommende Phospholipide oder bestimmte künstliche Polymere. Der Trick liegt in ihrem Aufbau: Amphiphile bestehen aus einem wasserliebenden (hydrophilen) und einem wassermeidenden (hydrophoben) Baustein. Dadurch erhalten sie eine wichtige Eigenschaft: Sie ordnen sich in wässriger Umgebung von selbst zu Kapseln. Dabei richtet sich der wassermeidende Teil zu anderen hydrophoben Bereichen hin, der wasserliebende Teil möchte eine maximal große Grenzfläche mit Wasser bilden und dreht sich nach außen. So entsteht die energetisch günstigste Architektur: eine Kugel.
Das Problem bei der Verwendung von Phospholipiden ist die geringe Stabilität der entstehenden Kapseln. Sie verlieren teilweise unterwegs ihre kostbare Fracht. Die langen Molekülketten der künstlichen Polymere hingegen verflechten sich bei der Selbstorganisation und erzeugen daher widerstandsfähigere Partikel. Doch die synthetischen Materialien sind dem Körper fremd und können oft nur schlecht abgebaut werden. Sie reichern sich an und lösen teilweise starke Abwehrreaktionen des Immunsystems aus.
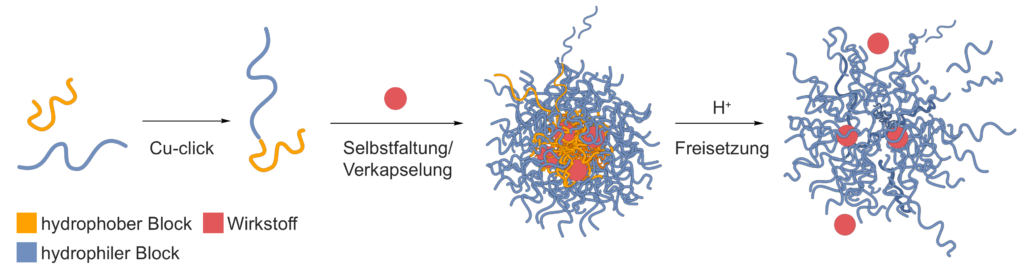
Unsere Idee war es daher die günstigen Eigenschaften beider Moleküle zu kombinieren und einen stabilen, biologisch abbaubaren Nanotransporter aus natürlich vorkommenden Zuckerpolymeren herzustellen. Dazu verwendeten wir Dextrane, lange Ketten vieler Glucosemoleküle, die wie Perlen auf einer Schnur hintereinander verknüpft sind. Im Vergleich zu synthetischen Polymeren können sie vom Körper gut zerlegt und ausgeschieden werden und lassen sich leicht chemisch modifizieren. Letztere wichtige Eigenschaft erlaubte uns den Einbau von Sollbruchstellen in unseren trojanischen Transporter. Schließlich sollte er seine Fracht nicht nur zum gewünschten Ziel bringen, sondern sie dort auch freisetzen.
Glucose, und damit auch das Dextran, ist grundsätzlich wasserlöslich, kann durch eine chemische Modifikation aber nach Bedarf hydrophober gemacht werden. Um einen hydrophoben Dextranbaustein herzustellen nutzten wir den folgenden Trick: die gute Wasserlöslichkeit von Dextranen ist an Alkoholgruppen entlang des Zuckerpolymerrückrats gebunden. Durch Absättigen der Alkohole mit sogenannten Acetalen wird das Polymer hydrophob. Der Knackpunkt dieser Methode ist, dass Acetale säureempfindliche Strukturen sind und während des natürlichen Verdauungsvorgangs in der Zielzelle leicht wieder zerfallen können. Sie funktionieren hier also wie ein pH-gesteuerter Schalter für die hydrophobe Eigenschaft. Bei saurer pH-Umgebung öffnet sich sozusagen die Bodenklappe des trojanischen Pferdes und entlässt die Krieger in die Zelle.

Amphiphile Bausteine für die Nanokapseln erzeugten wir schliesslich, indem wir jeweils eine hydrophile und eine hydrophobe Dextrankette über das letzte Kettenglied der beiden Zuckerpolymere chemisch verklebten. Dafür mussten wir beide Polymere zuvor genau an der gewünschten Stelle modifizieren. Die Herausforderung: bisherige Methoden hierfür sind sehr zeitintensiv und benötigen mehrere Tage. Das liegt daran, dass das Molekül am Kettenende sich wie der Bügel eines Vorhängeschlosses zeitweise öffnet und schließt. Leider lässt sich nur das offene Ende modifizieren, natürlicherweise liegt aber fast durchgehend das geschlossene, unreaktive Ende vor. Die Lösung war es die Reaktion in einer Mikrowelle durchzuführen um das Öffnen und Schließen zu beschleunigen. In einer Kombination mit bestimmten Aminbausteinen gelang es das offene Kettenende wie mit einem chemischen Angelhaken herauszufischen und die Polymere in nur vier Stunden zu modifizieren. Die verkürzte Reaktionszeit konnten wir für die Erforschung der eigentlichen Kapseln nutzen.
Erste Versuche zur Verknüpfung der hydrophilen und hydrophoben Dextranbausteine ergaben amphiphile Zuckerpolymere, die sich in Wasser spontan zu Kugeln zusammenlagerten und in schwach saurer Lösung wieder zerfielen. Unter einem normalen Lichtmikroskop kann man diesen Prozess allerdings nicht mehr beobachten. Die Partikel sind mit hundert Nanometern kleiner als die Wellenlänge des sichtbaren Lichts. Mit einem Laser, unter Ausnutzung der sogenannten dynamischen Lichtstreuung konnten wir sie dennoch sichtbar machen. Wie an Wassertröpfchen, die im Nebel den Lichtkegel des Autoscheinwerfers erscheinen lassen, werden dabei die Laserstrahlen an den Partikeln gestreut. Kleine Partikel schwimmen schneller und sorgen für eine schnelle Änderung der Streulichtstärke auf einem Sensor, große Partikel schwimmen langsamer und ändern sie dementsprechend langsamer. So konnten wir genau verfolgen ob- und wann die Partikel ihre Größe änderten.
Nach dem ersten Erfolg galt es noch eine weitere Nuss zu knacken, denn: verschiedene Arten von Tumorzellen können die Partikel wieder ausschleusen, bevor sie ihre Ladung freisetzen. Unsere Kapseln sollten ihre Schwimmfähigkeit daher im Inneren der Zelle verlieren. Chemisch übersetzt bedeutete das, dass der Transporter innerhalb der Tumorzelle seine hydrophile Hülle abwerfen sollte, um dort anschließend festzusitzen.
Um dies zu erreichen entwickelte ich eine Methode um die hydrophilen und hydrophoben Bausteine über zwei benachbarte Schwefelatome zu verknüpfen. Diese Struktur kommt häufig in Proteinen vor und stellt für Zellen eine bekannte Sollbruchstelle dar, die sie nach einer Aufnahme schnell spalten. Und tatsächlich: Beladen mit einem fluoreszierenden Wirkstoff, war es möglich unsere trojanischen Partikel in zuvor herangezüchtete Krebszellen zu schmuggeln. Mit Hilfe eines Fluoreszenzmikroskops konnte außerdem gezeigt werden, wie die leuchtenden Partikel aufgenommen wurden und der Wirkstoff in der Zelle verblieb.
Bis zu Ehrlichs magischer Gewehrkugel liegt allerdings noch ein gutes Stück Arbeit vor uns. Denn die industrielle Entwicklung von Biomaterialien für die Verkapselung von Chemotherapeutika befindet sich noch in den Kinderschuhen. Die Herausforderung liegt dabei vor allem in der Herstellung der Nanotransporter im großen Maßstab. Momentane Verfahren sind teuer und aufwändig. Doch es lohnt sich weiterzuforschen, denn das Potential, das in dieser Technologie steckt, ist enorm. Eine Technologie, die nicht zuletzt auch für den großen Erfolg der prominenten mRNA Impfstoffe unverzichtbar war.
Benjamin Breitenbach studierte 2009 biomedizinische Chemie in Mainz mit einem Forschungsaufenthalt an der University of Auckland, Neuseeland. In seiner Promotion an der Johannes Gutenberg-Universität Mainz forschte er an nanodimensionalen polymeren Therapeutika im Bereich Wirkstofftransport. Nach dem Abschluss 2019 folgte eine Stelle als Synthesechemiker in der Forschung und Entwicklung von selbst spaltenden Hydrogelen in einem pharmazeutischen Unternehmen in Heidelberg. Seit 2021 arbeitet er in Basel für ein schweizer Unternehmen in der industriellen Produktion von oligonucleotid basierten Pharmazeutika.


Ich trete dieser MRNA-Technologie eher skeptisch gegenüber.
@Florian: Im obigen Beitrag wird nicht über die mRNA-Technologie berichtet, sondern lediglich über Nanotransporter – und zwar über neuartige, zuckerbasierte Nanotransporter. Diese können Chemotherapeutika transportieren (wie im Beitrag als Forschungsziel angegeben) oder aber auch andere Dinge wie etwa mRNA. Nur gibt es für mRNA bereits gute Nanotransporter, für Chemotherapeutika aber noch nicht.
Nanotransporter scheinen eine grosse Zukunft zu haben. Und sie werden heute schon für Kosmetika und den mRNA-Transport benutzt.
Für Kosmetika werden Phospholipid-basierte Nanotransporter schon länger eingesetzt um etwa Vitamin A, B5 und E in tiefere Hautschichten zu transportieren.
Die Nanolipidhüllen für den mRNA-Transport bestehen aus 4 Komponenten: einen ionisierbaren Lipiden, deren positive Ladungen an das negativ geladene Rückgrat von mRNA binden, pegylierte Lipide, die zur Stabilisierung des Partikels beitragen, und Phospholipide und Cholesterinmoleküle, die zur Struktur des Partikels beitragen.
Im Internet liest man, dass die Entwicklung der Nanolipidhüllen für die mRNA-Impfstoffe 3 Jahrzehnte in Anspruch genommen hat. Das Prinzip wurde zwar früh entdeckt, lange dauerte es aber bis die 4 Komponenten ideal aufeinander abgestimmt waren und bis sie nicht mehr toxisch waren und sich nicht in der Leber anreicherten.
Hier wird über die nächste Generation von Nanotransportern berichtet, nämlich zuckerbasierte Nanotransporter, die ihre Eigenschaften je nach pH und ob sie extra- oder intrazellulär anwesend sind, ändern.
Das scheint äusserst attraktiv, vor allem wenn es zusätzlich noch gelingen würde, spezifisch nur gerade Tumorzellen anzusteuern.
Diese zuckerbasierten Nanotransporter selbst scheinen im Labor bereits gut zu funktionieren, jedoch scheint noch keine industrielle Fertigung in grossem Massstab möglich zu sein. Bis es soweit ist und bis diese Nanopartikel ihre medizinische Unbedenklichkeit bewiesen haben kann es aber wohl noch 10 Jahre oder mehr gehen.
Take-Home-Point: Viele Laien unterschätzen den Aufwand, der betrieben werden muss bis ein Pharmazeutikum oder nur schon ein Hilfsstoff alle Hürden genommen hat, bis er für medizinische Zwecke eingesetzt werden kann. Schon die mRNA-Impfstoffe, die bei Corona zum Einsatz kamen haben Jahrzehnte von Entwicklung hinter sich, selbst wenn der Kernbestandteil, die mRNA selbst, ganz schnell zur Verfügung stand.
Doch das – die Absicherung der medizinischen Unbedenklichkeit – muss wohl so sein. Schnellschüsse gibt es in der Medizin und ihren Hilfsdisziplinen kaum noch.