Streik bei der Antibiotika-Montage
Für ihre Bewerbung um den KlarText-Preis für Wissenschaftskommunikation 2020 in der Kategorie Biologie veranschaulichte Anna Degen, was sie in ihrer Promotion erforscht hat.
Wir haben verschiedene Module einer „Antbiotika-Montagelinie“ im Reagenzglas untersucht und stellen fest: Es wird schwierig Regeln zu finden, nach denen man die Module anders anordnen kann, um neue und potentiell bessere Antibiotika herzustellen.
Laut einer Schätzung des Weltwirtschaftsforums aus dem Jahr 2018 haben Antibiotika seit ihrer Entdeckung ungefähr 200 Millionen Menschenleben gerettet. Sie sind damit unter den Top 10 der Errungenschaften, die die weltweite Lebenserwartung im 20. Jahrhundert in die Höhe schießen ließen. Seither sind bakterielle Infektionen nicht mehr lebensgefährlich. Gleichzeitig sind auch moderne medizinische Behandlungen wie Transplantationen und Chemotherapie nur in Kombination mit potenten Antibiotika möglich.
Diese Potenz, also die Schlagkraft der Antibiotika gegen Bakterien, wird durch übermäßige Anwendung in der Tierzucht und beim Menschen, sowie durch unbedachte Entsorgung geschwächt. Denn auch für Bakterien gilt, Friedrich Nietzsches Maxime: „Was mich nicht umbringt, macht mich stärker“. Wenn Bakterien über eine längere Zeit einer zu geringen Konzentration eines Antibiotikums ausgesetzt sind, überleben sie nicht nur, sondern entwickeln Strategien, den Wirkstoff zu entfernen oder zu verändern und dadurch unschädlich zu machen. Als Resultat können diese Bakterien auch in der Gegenwart von vormals tödlichen Konzentrationen des Antibiotikums überleben: Sie sind resistent.
Die Gefahr, dass immer mehr resistente Bakterien entstehen und sich weiter ausbreiten hat die Weltgesundheitsorganisation als „eine der größten globalen Bedrohungen für die Gesundheit, Ernährungssicherung und Entwicklung“ identifiziert und einen weltweiten Aktionsplan erstellt. Zu den genannten Aktionen gehört es, über den Umgang mit und bedachten Einsatz von Antibiotika aufzuklären, die Ausbreitung resistenter Bakterien zu verhindern und neue Wirkstoffe zu entwickeln.
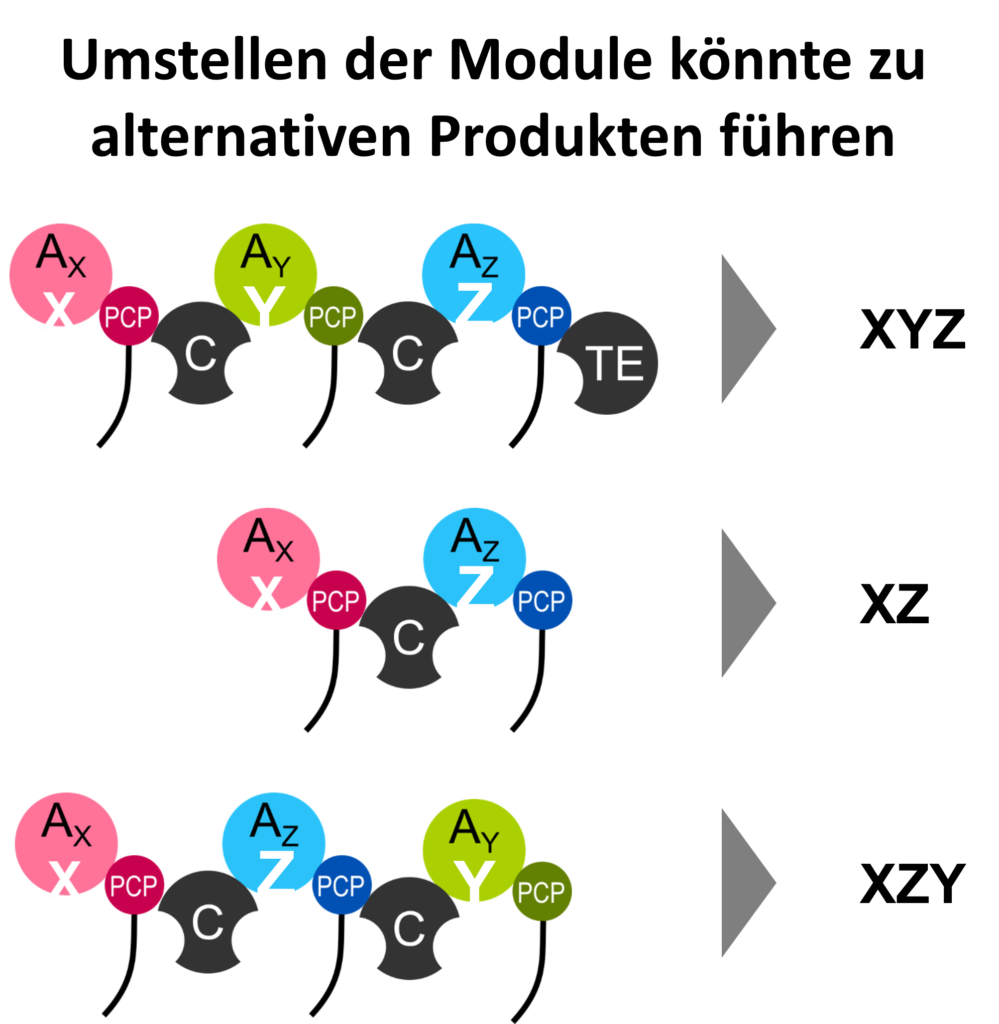
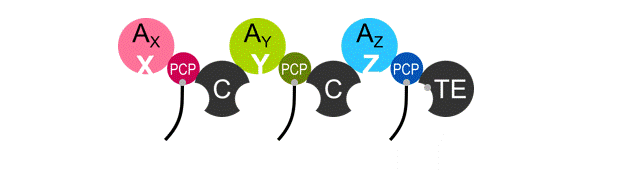
In der Natur werden Antibiotika in Bakterien und Pilzen von großen, modular aufgebauten Enzymen produziert, sogenannten „Nicht Ribosomalen Peptid Synthetasen“ oder kurz NRPS. Um den Produktionsprozess der Antibiotika zu veranschaulichen, stellen wir uns die Abläufe wie in einer Industriehalle vor: Die Enzyme entsprechen einer Montagelinie und jedes Modul dieser Linie fügt der Reihe nach ein bestimmtes Bauteil hinzu, bis das fertige Produkt, das Antibiotikum, von dem letzten Modul freigegeben wird. Die verwendeten Bauteile sind Aminosäuren, das fertige Produkt eine kurze Aminosäurekette, auch Peptid genannt. Um ein neues und potenziell potenteres Antibiotikum herstellen zu lassen, könnte man theoretisch die Module der Montagelinie neu anordnen und dadurch ein neues Produkt erhalten. In der Praxis haben diese Idee schon viele Forschungsgruppen weltweit ausprobiert, aber das Ergebnis war enttäuschend. Die neu angeordneten Montagelinien haben – mit wenigen Ausnahmen – gar kein Antibiotikum mehr produziert. Warum? Das haben wir im Reagenzglas anhand einer bestimmten Montagelinie untersucht, bei der wir einzelne Module ausgeschaltet und den Einfluss auf die benachbarten Module untersucht haben. Unsere Ergebnisse bestätigen, dass es schwierig ist die Module zu einer neuen Montagelinie richtig umzustellen, da sich keine Regeln herleiten lassen, wie einzelne Module auf eine Veränderung ihrer benachbarten Module reagieren, ob sie zum Beispiel streiken – oder eben nicht.
Um die Montage fehlerfrei durchführen zu können, besteht ein Modul aus verschiedenen Unterstrukturen, mit jeweils einer Aufgabe. In der (i) Formprüfungs- und Aktivierungsstation wird eine Vielzahl an Bauteilen, die im Zellinneren herumschwimmen, begutachtet, geprüft und nur das Passende wird aktiviert, also in den Bauprozess eingeschleust. Der (ii) Roboterarm greift das aktivierte Bauteil auf und transportiert es weiter zur (iii) Schweißstation. Hier werden die Bauteile zweier benachbarter Module zusammengeschweißt. Durch die Wiederholung der Schritte (i)-(iii) an jedem Modul wandert und wächst das Antibiotikum entlang der Montagelinie. Am Ende wartet die (iv) Versandstation, wo das Produkt in eine andere Form, zum Beispiel in eine Kreisform, gebracht und dann verschickt wird.
Die Reihenfolge und die Anzahl der Module in der Montagelinie bestimmen die Anordnung der Bauteile und die Größe des fertigen Produkts. Montagelinien können aus zwei bis 25 Modulen bestehen, ihre Produkte folglich zwischen zwei und 25 Bauteile lang sein. Der Clou daran ist, dass viele verschiedene Module zur Auswahl stehen, um eine Montagelinie zu bilden. Dementsprechend stehen bis zu 500 verschiedene Bauteile zur Verfügung, die sie nutzen können. Das erklärt die beobachtete große Vielfalt von Produkten, die auf diesem Weg gefertigt werden und von denen Zahlreiche eine biologische Funktion, wie eben eine antibakterielle Wirkung, aufweisen.
Als Reaktion auf sich verändernde Lebensbedingungen haben Bakterien und Pilze die Module immer wieder umgestellt, um neue Produkte zu entwerfen, die ihnen einen evolutionären Vorteil bieten. Dadurch kamen Forscher auf die Idee diese Strategie auch auszuprobieren. Die Natur hat potente Antibiotika entworfen und uns deren Montagelinie gleich mitgeliefert. Wenn wir also neue Antibiotika benötigen, können wir Module der Montagelinie austauschen und testen, ob das neuartige Produkt wieder gegen eigentlich resistente Bakterien wirksam ist. Falls dem so ist, können wir schnell und umweltfreundlich große Mengen davon in einem Bioreaktor produzieren.
Nach einigen Testreihen folgte Ernüchterung. Leider funktionieren die allermeisten neu entworfenen Montagelinien nur noch sehr schlecht oder gar nicht mehr. Wie in echten Industriehallen kommt es auch auf der molekularen Ebene sehr darauf an, an welcher Stelle man die Module auseinandernimmt und wieder neu zusammensetzt. Wenn sie zu weit auseinander stehen, in verschiedene Richtung zeigen oder sich gegenseitig in die Quere kommen, können die Module nicht zusammenarbeiten und der Produktionsprozess gerät ins Stocken oder kommt ganz zum Erliegen.
Durch das Vergleichen der Anordnung verschiedener Montagelinien wurden viele Schnittstellen zum Austauschen von Modulen getestet. Tatsächlich konnten einzelne Erfolge vermeldet werden. Zum Beispiel konnte ein existierendes Antibiotikum durch Austausch eines Bauteils potenter gemacht und sein Anwendungsspektrum erweitert werden. Andererseits führte ein drittes Modul an gleicher Stelle wieder zum Streik der Montagelinie. Das heißt, man kann nicht von einem erfolgreichen Austausch auf den Erfolg eines Anderen schließen. Generelle Regeln lassen sich also bisher nicht ableiten.
Durch diese Erkenntnis stellte die Projektleiterin Dr. Barbara Di Ventura, Professorin an der Fakultät für Biowissenschaften der Universität Freiburg, fest: „Die Kommunikation mit neuen Nachbarn in der Montagelinie klappt also selten, aber wie ist das bei Modulen, die schon lange nebeneinander arbeiten? Kommunizieren die miteinander? Verhalten sie sich unterschiedlich, je nachdem wer ihr Nachbar ist und wie er sich verhält?“. Als wir erkannten, dass es noch keine Antworten auf diese Fragen gab, war unser Ziel klar: Wir wollen herausfinden, ob die Module einer Montagelinie sich gegenseitig beeinflussen und was passiert, wenn zum Beispiel das Nachbarmodul streikt.
Mit diesem Ziel isolierten wir die letzten drei von insgesamt zehn Modulen der Montagelinie des Antibiotikums Tyrocidine, das bei Menschen Nebenwirkungen hervorruft und daher nicht mehr als Therapie verabreicht wird. Wir isolierten verschiedene Versionen, um sie miteinander zu vergleichen: Die drei einzelnen Module ohne Nachbarn, zwei aufeinanderfolgende Module mit je einem Nachbarn und alle drei Module hintereinander. Den Streik einzelner Module lösten wir auf zwei Arten aus: Entweder (a) schalteten wir die Aktivierungsstation oder den Roboterarm durch gezielte Mutationen aus, oder (b) wir ließen das Bauteil, das von dem Modul aktiviert wird in dem Experiment weg.
Wir untersuchten die Module in An- und Abwesenheit ihrer Nachbarn und den Einfluss, den die Streiks der Nachbarn auf sie haben. Dazu nutzten wir eine Methode, die zeigt, ob und wie oft ein Modul sein Bauteil aktiviert. Wir passten die Methode an, um die vielen Module in ihrer unterschiedlichen Umgebung und unter den jeweiligen Streikbedingungen messen zu können. Mit Hilfe von Prof. Mootz (Universität Münster) konnten wir die Produkte identifizieren, die von den Montagelinien mit und ohne Streik hergestellt wurden.
Wir fanden heraus, dass die Aktivität aller Module abhängig von ihrer Umgebung stark und unvorhersehbar variierte. Manche Module arbeiteten wesentlich schneller, wenn ihre Nachbarn auch arbeiteten. Andere nicht. Eines der Module fing an zu streiken, als der Vordernachbar streikte. Ein anderes hingegen blieb davon unbeeindruckt und aktivierte weiter sein Bauteil. Einzig die Produktion kam wie erwartet beim Streik nur eines Moduls der Linie zum Erliegen, auch wenn die anderen Module weiterarbeiteten.
Aus diesen Ergebnissen schließen wir, dass die Module einer Montagelinie miteinander kommunizieren. Es bleibt unklar, wie. Außerdem verhalten sich die Module unter verschiedenen Bedingungen unvorhersehbar. Und das, obwohl sie die Nachbarn in unseren Experimenten schon kennen. Das deutet darauf hin, dass es sehr schwierig sein wird, das Verhalten neuer Nachbarn in einer Montagelinie vorherzusagen. Aufgrund unserer Erkenntnisse, denken wir, dass ein alternativer Ansatz mit größerer Wahrscheinlichkeit zu dem Ziel führt, neuartige Antibiotika durch das Umstrukturieren der Montagelinie zu entwickeln: das Nutzen von Methoden, die mit hohem Durchsatz viele neue Montagelinien herstellen und auf Funktionalität testen können.
Anna Degen wuchs im Saarland auf und besuchte das Albert Einstein Gymnasium in Völklingen mit einem Zwischenstopp von einem Jahr an der Osbourn Park High School in Virginia, US. Das Studium der Molekularen Biotechnologie „MoBi“ führte sie an die Universität Heidelberg mit Forschungsaufenthalten in Cambridge, UK und Rockville, Maryland, US. In ihrer Promotion am Deutschen Krebsforschungszentrum (DKFZ) untersuchte sie die Funktionsweise Nichtribosomaler Peptidsynthetasen (NRPSs). Seit 2020 ist sie Produktspezialistin für Personalisierte Peptide, deren Einsatz als Bestandteil personalisierter Immunkrebstherapie in klinischen Studien untersucht wird, bei Pepscan in den Niederlanden.