MARVEL – ein Superheld unseres Nervensystems
Für ihre Bewerbung um den KlarText-Preis für Wissenschaftskommunikation 2021 in der Kategorie Biologie veranschaulichte Maria Eichel-Vogel, was sie in ihrer Promotion erforscht hat.
Um schnell auf Reize aus der Umwelt reagieren zu können, benötigen Organismen aller Art eine präzise und zügige Reizweiterleitung entlang der Nervenfasern. Doch ist schneller auch gleich besser?
Wer Comic Fan ist oder regelmäßig ins Kino geht kennt sie: Captain Marvel, Spiderman, Hulk – die MARVEL-Superhelden, die öfter die Welt retten und ein Millionen Publikum begeistern. Während meiner Doktorarbeit am Max-Planck-Institut für Experimentelle Medizin habe ich einen MARVEL-Helden in unserem Nervensystem entdeckt. Hier kommt seine Geschichte.
Unser Nervensystem ist unabdinglich in unser aller Leben involviert: vom Atmen bis hin zu komplexen Entscheidungen, die wir im Alltag fällen. Vieles davon wird von unserem zentralen Nervensystem, zusammengesetzt aus Gehirn und Rückenmark, gesteuert. Doch zum Universum Nervensystem gehört mehr. Wenn wir unsere Füße am See in kaltes Wasser tauchen, sind auch Nervenfasern entlang unseres gesamten Körpers involviert. Diesen Teil nennt man das „periphere Nervensystem“. Elektrische Signale werden entlang der Nervenfasern geleitet und melden an das Gehirn: „Das Wasser ist zu kalt, zieh die Füße heraus“. Durch Rückleitung entlang unserer Nervenfasern sind wir dann in der Lage, unsere Muskeln anzuspannen und die Füße schnell aus dem Wasser zu ziehen. Die unzähligen ineinandergreifenden Prozesse, die in unserem Nervensystem stattfinden bilden ein aufregendes Forschungsfeld, indem es noch viel zu entdecken gibt.
Die elektrischen Signale entlang der Nervenfasern werden Nervenimpulse genannt und ähneln Strom, der entlang eines Kabels fließt. In der Natur muss das schnell und präzise funktionieren. Stellen wir uns mal vor, wie schnell eine Giraffe mit ihren langen Nervenfasern reagieren muss, um vor einem Leoparden zu flüchten. Wie also kann ein Organismus so eine schnelle Reizweiterleitung erreichen? Erste Möglichkeit: ein breiteres Kabel. Denn durch dickere Nervenfasern wird der Widerstand gegen das elektrische Signal geringer, da mehr Platz zur Verfügung steht, wodurch das Signal schneller weitergeleitet wird. Bereits im Jahr 1950 wiesen Forscher experimentell nach, dass dickere Nervenfasern mit erhöhter Reizweiterleitung einhergehen. Doch in unserem Nervensystem ist nicht unendlich viel Platz für sehr dicke Nervenfasern. Darum entwickelte sich im Laufe der Evolution in Wirbeltieren eine zweite Möglichkeit, die Reizweiterleitung zu erhöhen: Die Ummantelung von Nervenfasern mit einer fettreichen Schicht, der Myelinscheide. Das kann man sich wie bei der äußeren Schicht eines Kabels, der Isolierung, vorstellen. In unseren Nervenfasern springt das elektrische Signal über die von Myelin ummantelten, isolierten Bereiche hinweg und das Signal wird weniger abgeschwächt. Dadurch wird die Leitgeschwindigkeit erhöht. Durch die Ummantelung mit Myelin ist die Reizweiterleitung auch bei dünneren Nervenfasern und über lange Strecken hinweg sehr schnell. Außerdem verbrauchen dünnere Nervenfasern weniger Energie und weniger Platz. So kann auch die Giraffe schnell vor einer Gefahr flüchten.
Wir wissen also, dass dicke Nervenfasern schneller leiten, aber auch, dass sie durch Myelin nicht dicker werden müssen, um trotzdem schnell zu leiten. Doch wer bildet eigentlich das Myelin? Im peripheren Nervensystem sind es die nach Theodor Schwann benannten Schwannzellen. Bisherige Forschungsergebnisse konnten zeigen, dass die Dicke einer Nervenfaser bestimmt, wie viel Myelin gebildet wird, aber auch, dass Nerven erst ab einer bestimmten Dicke myelinisiert werden. Das heißt, die Myelin-bildende Schwannzelle und die Nervenzelle müssen miteinander kommunizieren. Diese Kommunikation versucht die Abteilung Neurogenetik unter der Leitung von Klaus-Armin Nave am Max-Planck-Institut für experimentelle Medizin besser zu verstehen.
Im ersten Schritt haben wir uns biochemische Methoden zu Nutze gemacht, um uns diese molekularen Kommunikationswerkzeuge in der Kontaktzone zwischen Nervenfaser und Myelin genauer anzuschauen. Dabei sind wir auf meinen persönlichen Superhelden gestoßen: CMTM6, ein Protein dessen vollständiger Name „Chemokine-like factor-like MARVEL-transmembrane domain-containing family member-6“ lautet. Hat das Comic Universum MARVEL was damit zu tun? Nein. MARVEL beschreibt in diesem Fall eine bestimmte Architektur, die in verschiedenen Proteinen vorkommt. CMTM6 ist trotzdem mysteriös: die Rolle, der erst im Jahr 2003 entdeckten Proteine der CMTM-Familie im Nervensystem war zu diesem Zeitpunkt komplett unerforscht. Unsere Motivation, zu ergründen, ob wir einen MARVEL-Helden mit Superkräften haben, war geweckt.
Die Funktion eines Proteins für einen bestimmten Zelltyp kann man am besten untersuchen, indem man das Protein aus der Zelle entfernt. Das ist bei uns Menschen schwierig, aber glücklicherweise ähnelt unser Nervensystem in Aufbau und Funktion dem einer Maus. Um nun eine Maus zu erzeugen, die kein CMTM6 in ihren Schwannzellen hat, machen wir uns ein genetisches Werkzeug zu Nutze. Das kann man sich wie folgt vorstellen: Eine Art Gen-Schere schneidet entlang einer von uns definierten Linie, die innerhalb des CMTM6 Gens liegt. Dadurch wird ein Genabschnitt aus dem Erbgut gelöscht. Im Normalfall wird von den Genen abgelesen, welches Protein entsteht, aber für CMTM6 ist der Genabschnitt nun defekt. Die Folge: der Text macht keinen Sinn mehr und das Protein wird nicht gebildet. Je nachdem welche Gen-Schere man benutzt, passiert das nur in bestimmten Zelltypen, in unserem Falle in Schwannzellen.
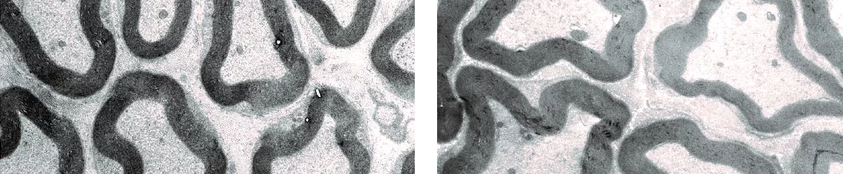
Was sehen wir wohl in den Nerven von Mäusen, denen CMTM6 in der Schwannzelle fehlt? Die ersten Bilder mit dem Elektronenmikroskop sind für mich stets die spannendsten Momente und nach den ersten Auswertungen berichtete ich der Arbeitsgruppe begeistert von dem Ergebnis: Nervenfasern in verschiedenen peripheren Nerven waren dicker, wenn Schwannzellen CMTM6 fehlt. Das heißt: Im Normalzustand wirkt CMTM6 wie eine Bremse auf das Dickenwachstum von Nervenfasern und reguliert, dass diese nicht zu groß werden. Damit hatten wir das erste Protein entdeckt, was eine solche Funktion übernimmt – ein echter Superheld! In meiner Arbeit konnte ich außerdem zeigen, dass größere Nervenfasern in unserem Mausmodell auch etwas dickeres Myelin haben.
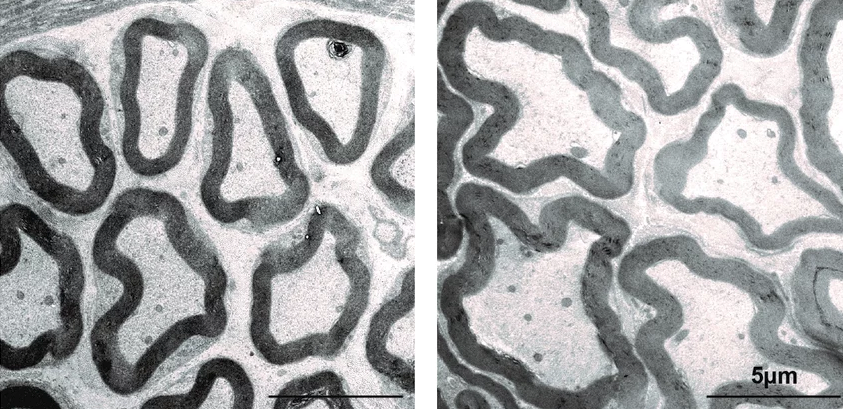
War da nicht etwas mit Myelin, Dicke der Nervenfaser und Geschwindigkeit der Reizweiterleitung? Richtig! Mittels elektrophysiologischer Messungen konnten wir zeigen, dass die Mäuse mit den dickeren Nervenfasern, in der Tat schnellere Reizweiterleitung im Vergleich zu Kontrollmäusen aufweisen. Auch im Verhalten konnten wir Veränderungen feststellen. So reagierten unsere Mäuse schneller auf Wärmereize im Vergleich zu Mäusen, die noch CMTM6 in Schwannzellen haben. Diese Superkräfte haben aber, wie so oft, einen Preis. Wir konnten zeigen, dass die genetisch veränderten Mäuse wahrscheinlich Probleme haben, ihre schnelleren Reize zu koordinieren. Wie bei Superhelden ist ein sensibles Gleichgewicht wichtig. Zu große Nervenfasern führen zu Platzproblemen; verbrauchen mehr Energie. Zu kleine Nervenfasern, oder Fehler in der Myelinschicht, bremsen die Reizweiterleitung. Das kann zu Krankheiten führen.
Durch die Möglichkeit, komplexe Zusammenhänge im Tiermodell zu untersuchen, konnten wir zeigen, dass die Superheldenkraft von unserem „marvelous“ (zu Deutsch fabelhaften) CMTM6 Protein darin besteht das Wachstum von Nervenfasern im Zaum zu halten. Es gibt allerdings zwei Seiten der Medaille: Größer und schneller muss nicht immer besser sein. Superheldenpotential für uns Menschen können die neuen Erkenntnisse trotzdem haben. Stoffwechselstörungen wie Diabetes mellitus, genetische Erkrankungen oder Quetschungen durch Unfälle führen zu Schädigungen unserer Nerven und stören die Reizweiterleitung. Es treten Fehler im Myelin und oft kleinere Durchmesser der Nervenfasern auf. Zukünftige Experimente werden zeigen, ob wir mit dem Ausschalten von CMTM6 Krankheitsbilder verbessern können und CMTM6 einen Ansatzpunkt für Therapien liefert. Und wie oft in der Forschung, eröffnet eine Antwort weitere Fragen: Woher weiß eine Nervenfaser wie dick sie werden soll? Wer beeinflusst das Gleichgewicht noch? Fortsetzung folgt…

Maria Eichel-Vogel studierte Molekulare Biotechnologie, sowie Entwicklungs-, Neuro- und Verhaltensbiologie an den Universitäten Dresden und Göttingen. Sie war stets begeistert davon, wie Zellen als kleinste Einheiten unseres Körpers miteinander kommunizieren. In ihrer Doktorarbeit in der Forschungsgruppe von Hauke Werner am Max-Planck-Institut für experimentelle Medizin (jetzt Multidisziplinäre Naturwissenschaften) in Göttingen, untersuchte sie die Kommunikation zweier Zelltypen im peripheren Nervensystem genauer. Seit Ende 2021 konzentriert sie sich als Postdoktorandin an der Universität Edinburgh auf die Frage, was die Größe unserer Nervenfasern bestimmt.


CMTM6 wirkt also als chemischer Antagonist und vermindert die Erzeugung von Myelin. Anstatt einfach weniger Myelin zu erzeugen oder Nervenfasern von sich aus weniger wachsen zu lassen, kommt hier also ein wachstumshemmender Stoff, nämlich CMTM6, zum Einsatz. Es wird also mittels chemisch entgegengesetzt wirkenden Stoffen ein Gleichgewicht aufrecht erhalten.
CMTM6 scheint erst kürzlich entdeckt worden zu sein und es gibt Hinweise darauf, dass es mehrere Funktionen ausübt, also nicht nur das Wachstum von Nervenfasern reguliert, sondern auch noch andere Funktionen im Körper übernimmt. So berichtet der Artikel CMTM6 maintains the expression of PD-L1 and regulates anti-tumour immunity darüber, dass CMTM6 eine wichtige Rolle bei der Regulierung von programmed death-1 (PD-1) ligand 1 spielt, welches wiederum eine wichtige Rolle in der T-Zell-vermittelten Immunüberwachung und damit in der Tumorkontrolle spielt.