Die unterschätzte Synapse

Für seine Bewerbung um den KlarText-Preis für Wissenschaftskommunikation 2020 in der Kategorie Neurowissenschaften veranschaulichte Georg Welzel, was er in seiner Promotion erforscht hat.
Welche Rolle spielen elektrische Synapsen in unserem Gehirn?
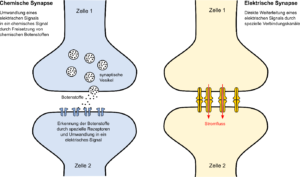
Nervenzellen in unserem Gehirn sind miteinander über chemische Synapsen verbunden. An diesen engen Kontaktstellen zwischen Zellen werden Informationen in Form von chemischen Botenstoffen weitergegeben. Die chemischen Synapsen können sich strukturell und funktionell verändern und dadurch entscheiden, wie effektiv Informationen an andere Nervenzellen übermittelt werden. Durch ihre Anpassungsfähigkeit bilden sie die Grundlage für das Lernen und die Gedächtnisbildung. Nervenzellen kommunizieren aber auch über direkte elektrische Verbindungen miteinander. Diese elektrischen Synapsen sind bisher wenig untersucht, könnten aber eine ebenso wichtige Rolle bei Lernvorgängen spielen.
Eine endlose erscheinende Kongresshalle im sonnigen Kalifornien, in der sich 30.000 Neurowissenschaftler aus aller Welt tummeln. Auf tausenden Postern und in hunderten Vorträgen diskutieren sie die neuesten Erkenntnisse aus allen Bereichen der Neurowissenschaften. Das ist die weltweit größte Tagung der Neurowissenschaften. Und mittendrin stand ich zusammen mit meinen Kollegen des Lehrstuhls für Tierphysiologie der Universität Bayreuth. Völlig fasziniert von den vielen neuen Erkenntnissen drängten wir uns durch die endlos erscheinenden Gänge, von einem Poster zum nächsten. Doch unerwartet hielten wir für einen Moment inne. Inmitten dieses Getümmels trafen wir auf Eric Kandel, den berühmtesten Gedächtnisforscher unserer Zeit und Nobelpreisträger für Physiologie und Medizin. Auch wenn nur Zeit war ein paar Worte mit ihm zu wechseln, so war diese Begegnung absolut prägend für die eigene weitere Forschung.
Eric Kandel war es, der erstmals Licht in viele bis dahin ungeklärte und faszinierende Fragen über unser Gehirn brachte. Seine Forschungen deckten auf, wie es möglich ist, dass Nervenzellen in unserem Gehirn scheinbar unendlich viele Informationen abspeichern und diese zum Teil ein Leben lang wieder abrufen können. Das heutige Verständnis des Lernens und der Gedächtnisbildung in unserem Gehirn verdanken wir seinen grundlegenden Arbeiten in den 1960er Jahren an den Nervenzellen von bizarr aussehenden Meeresschnecken.
Für seine Idee, anhand des primitiven Nervensystems der Meereschnecke unser komplexes Gehirn verstehen zu wollen, wurde Eric Kandel anfangs sicher oft belächelt. Doch sein Grundgedanke war genial. Er ging davon aus, dass die grundlegenden Prinzipien des Lernens und des Gedächtnisses bei allen Tieren gleich sind und sich diese an einem einfachen Modell wie der Meeresschnecke mit ihren wenigen und riesigen Nervenzellen sicherlich einfacher aufklären lassen, als in einem komplexen Gehirn wie unserem.
Und genau dieser Ansatz ebnete ihm den Weg zu seinem großen Erfolg. Es gelang ihm die grundlegenden molekularen und zellulären Mechanismen des Lernens aufzuklären. Eine zentrale Rolle spielt hierbei die Kommunikation zwischen Nervenzellen. Informationen werden im Gehirn in der Regel an Kontaktstellen zweier Nervenzellen, den Synapsen, in Form von chemischen Botenstoffen weitergegeben. Diese chemische Form der Informationsübertragung kann verstärkt oder verringert werden, abhängig davon, wie aktiv eine Nervenzelle ist. Ist ihre Aktivität sehr hoch, führt das beispielsweise dazu, dass diese auch mehr Botenstoffe an eine benachbarte Nervenzelle weitergibt. Die Effektivität chemischer Synapsen wird also aktivitätsabhängig angepasst. Dies ist ein andauernder Prozess, der dazu führt, dass sich chemische Synapsen ständig verändern. Die Untersuchungen an der Meeresschnecke brachten ans Licht, dass genau diese Formen der synaptischen Anpassungen eine zentrale Rolle beim Lernen und der Gedächtnisbildung spielen. Obwohl die Meeresschnecke nur sehr weit entfernt mit uns verwandt ist, verwendet unser Gehirn die gleichen Mechanismen, um Informationen zu speichern.
Infolgedessen erlebte die chemische Synapse in der neurowissenschaftlichen Forschung bis heute einen Höhenflug. Lange Zeit erschien es nicht denkbar, dass auch der zweite Typ von Synapsen in unserem Gehirn, die elektrischen Synapsen, einen Beitrag zu Lernvorgängen leistet. Dies lag vermutlich daran, dass sowohl der Aufbau der elektrischen Synapse als auch die Art der Signalweitergabe auf dem ersten Blick vergleichsweise einfach erscheint. An elektrischen Synapsen sind zwei benachbarte Zellen direkt durch eine Art Tunnel miteinander verbunden. Die gängige Lehrbuchmeinung war lange, dass diese Tunnel starre unveränderbare Strukturen sind, deren einzige Aufgabe es ist elektrische Stromflüsse direkt von einer Zelle zur nächsten Zelle weiterzuleiten. Daher ist es auch nicht verwunderlich, dass man ihnen nicht zutraute, eine ähnliche Rolle bei Lernvorgängen zu spielen wie die chemische Synapse.
Nervenzellen kommunizieren miteinander über chemische oder elektrische Synapsen. Dabei werden Informationen entweder in Form von chemischen oder elektrischen Signalen weitergegeben. ©Georg Welzel
In den vergangenen zwei Jahrzenten gerieten die elektrischen Synapsen jedoch überraschend wieder ins Rampenlicht. Einzelne Forscherinnen und Forschera lieferten erste Indizien, dass elektrische Synapsen sehr wohl veränderbar sind und sogar ihre Stärke aktivitätsabhängig anpassen könnten. Das heißt, auch bei elektrischen Synapsen kann die Stärke der synaptischen Übertragung erhöht oder verringert werden, je nachdem wie stark sie genutzt wird. Das ist eine Eigenschaft, die man zuvor nur von chemischen Synapsen kannte. Sind elektrische Synapsen also genauso veränderbar wie chemische Synapsen und spielen eine vergleichbare Rolle beim Lernen?
Um diese Frage zu beantworten, muss der Strom, der durch die elektrischen Synapsen fließt, direkt gemessen werden. Das ist jedoch gar nicht so einfach, denn in einer Nervenzelle herrscht ein großes Durcheinander an Stromflüssen. Mit einem kleinen Trick und ganz speziellen Messtechniken ist es dennoch möglich, die sehr kleinen Ströme, die durch eine elektrische Synapse fließen, erkennen und messen zu können. Hierfür werden zwei mikroskopisch feine Messelektroden verwendet, dessen Spitzen um ein Vielfaches dünner sind als ein menschliches Haar. Die Kunst besteht nun darin, die fast unsichtbaren Spitzen der beiden Elektroden jeweils in das Innere der beiden verbundenen Nervenzellen einzustechen. Doch ist das erst einmal gelungen, hat man die volle Kontrolle über die Zellen. Es lässt sich beispielsweise mit Hilfe der Elektroden die Aktivität der beiden Nervenzellen gezielt herunterfahren. In diesem Ruhezustand verschwinden dann alle störenden elektrischen Signale und der Stromfluss durch eine elektrische Synapse kann durch einen Reiz ausgelöst und gemessen werden.
Diese Vorgehensweise ist jedoch methodisch sehr anspruchsvoll und bei sehr komplex aufgebauten Nervenzellen im Gehirn von Wirbeltieren nicht fehlerfrei anwendbar. Zum einen sind die Zellen dort oft nur schwer zugänglich und zum anderen lässt sich aufgrund ihrer komplexen Struktur ihre elektrische Aktivität mit einer Messelektrode nicht vollständig kontrollieren. Nichtsdestotrotz stammen alle Hinweise auf eine aktivitätsabhängige Veränderung elektrischer Synapsen aus Experimenten mit genau solchen Nervenzellen. Dies führte dazu, dass der Stromfluss durch die Synapse und dessen mögliche Anpassungen immer nur abgeschätzt werden konnte.
Damit wollten Professor Stefan Schuster und ich uns aber nicht abfinden und so machten wir uns auf die Suche nach einem Modellsystem, bei welchem die Ströme einer elektrischen Synapse direkt und zuverlässig messbar sind. Und so wie Eric Kandel das primitive Nervensystem einer Meeresschnecke wählte, um die Grundprinzipien des Lernens bei chemischen Synapsen zu verstehen, so kamen auch wir zu dem Entschluss, ein möglichst einfach aufgebautes Nervensystem zu verwenden, um die elektrische Synapse zu verstehen.
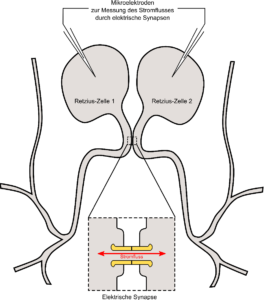
Fündig wurden wir im Nervensystem des medizinischen Blutegels. Auch hier finden sich riesige, paarig angeordnete Nervenzellen, die sogenannten Retzius-Zellen, welche über elektrische Synapsen direkt miteinander kommunizieren. Der Vorteil dieser Zellen ist zum einen ihre Größe, wodurch sie leicht zu finden und zu untersuchen sind. Und zum anderen liegen die elektrischen Synapsen in unmittelbarer Nähe zu den Zellkörpern, wo sich die Messelektroden befinden. Dies ist der entscheidende Vorteil gegenüber den Nervenzellen aus Wirbeltieren. In zahlreichen Experimenten konnten wir nachweisen, dass alle Messtechniken bei den Retzius-Zellen des Blutegels anwendbar und der Strom, der durch die elektrischen Synapsen zwischen den beiden Zellen hin- und her fließt, korrekt und fehlerfrei messbar ist.
Die beiden Retzius-Zellen im Nervensystem des Blutegels sind über elektrische Synapsen direkt miteinander verbunden. Die Ströme, die durch diese Synapsen fließen, können mit sehr feinen Mikroelektroden und speziellen technischen Geräten gemessen werden. ©Georg Welzel
Damit hatten wir das passende Werkzeug, um erstmals direkt die Frage zu beantworten: Ist es tatsächlich möglich, dass auch die elektrische Kommunikation zwischen zwei Nervenzellen in Abhängigkeit von deren Aktivität verstärkt oder abgeschwächt wird? Um der Sache auf den Grund zu gehen, haben wir die beiden Retzius-Zellen dazu angeregt, für verschieden lange Zeit besonders aktiv zu sein. Der entscheidende Punkt war dann, ob die Stärke der elektrischen Synapsen direkt nach dieser Aktivitätsphase größer oder kleiner war als zuvor. Überraschenderweise zeigten unsere Messungen, dass bereits eine 10 Minuten anhaltende Aktivitätsphase ausreichend ist, um die elektrische Übertragung zwischen den beiden Zellen langanhaltend zu erhöhen. Wie bei chemischen Synapsen, war auch bei den elektrischen Synapsen die beobachtete Verstärkung abhängig von der Menge an verfügbaren Kalzium-Ionen in der Zelle. Das lässt vermuten, dass die Nervenzellen in Reaktion auf ihre erhöhte Aktivität Kalzium-abhängige Prozesse in Gang setzen, welche am Ende die Veränderung der elektrischen Synapsen verursachen. Wer weiß, vielleicht sind es ja die gleichen Prozesse, die auch die Stärke chemischer Synapsen regulieren?
Uns gelang damit der erste direkte Nachweis von aktivitätsabhängigen Anpassungen bei einer elektrischen Synapse. Wir konnten dazu auch erstmalig beweisen, dass sogar die elektrischen Synapsen in dem einfach aufgebauten Nervensystem eines Blutegels derartige Fähigkeiten besitzen. Durch die Nutzung dieses einfachen Modellsystems bieten sich für die zukünftige Erforschung elektrischer Synapsen völlig neue Möglichkeiten. Es könnte dazu genutzt werden, zu verstehen, was genau während aktivitätsabhängiger Veränderungen an der elektrischen Synapse passiert. Mit diesem Wissen könnte dann vielleicht auch die Frage geklärt werden, ob beim Lernen und der Gedächtnisbildung in unserem Gehirn die elektrischen Synapsen womöglich einen wichtigen Beitrag leisten.
Georg Welzel wurde 1988 in Erlangen geboren. Von 2008 bis 2014 studierte er Biologie an der Universität Bayreuth. Nach seiner Master-Arbeit am BioMed Center in Bayreuth forschte er am Lehrstuhl Tierphysiologie der Universität Bayreuth, wo er 2019 seine Dissertation mit dem Titel “Neuronal plasticity – the adaptive capacity of nervous systems” erfolgreich abschloss. Heute ist er Postdoktorand am gleichen Institut und beschäftigt sich mit stark elektrischen Fischen.


Dendriten, das Axon und Synapsen machen das Neuron komplex
80 Milliarden Neuronen hat es im menschlichen Hirn. Für Forscher sind das zu viele Neuronen, für Ingenieure aber, die Computerchips bauen sind das gar nicht so viele, denn der heute grösste Computerchip, der AMD-Chip Epyc Rome, welcher auf dem Core Zen 2 basiert, enthält 39 Milliarden Transistoren, also etwa halb soviel Transistoren wie das menschliche Gehirn Neuronen besitzt. Doch dieser Vergleich hinkt, denn ein Transistor ist nur ein sehr einfacher elektronischer Schalter, während ein Neuron eine hochkomplexe Zelle ist, welche Nervensignale über ein Axon zu weit entfernten anderen Nervenzellen senden kann und welches über ein fein verzweigtes Geäst von Dendriten Signale von anderen Nervenzellen empfangen kann. An den Übergängen befinden sich Synapsen und diese können wie hier beschrieben Signale verschieden stark von einer zur ananderen Nervenzelle weiterleiten. Und die Übertragungsstärke kann sich sogar in einem Lernprozess ändern.
Kurzum: Neuronen sind unter anderem wegen ihren Synapsen um ein Vielfaches komplexer als die in der Elektronik verwendeten Transistoren. Das heisst nicht, dass ein Nachbau nicht möglich ist, sondern nur, dass wir noch weit davon entfernt sind, ein Gehirn nachbauen zu können.
Ich finde diese Vergleiche von Computern und Gehirnen irgendwie schräg. Beide funktionieren und leisten gänzlich anderes, ergo ist ein Vergleich selten sinnvoll.
@einer (Zitat):„ Beide [Computer, Hirn] funktionieren und leisten gänzlich anderes“
Nicht unbedingt. Schon Alain Turing zeigte, dass jeder Computer mit einer bestimmten Basisfunktionaliät, alles berechnen kann, was berechenbar ist. Ein menschliches Hirn kann letztlich auch nicht mehr berechnen als eine Turing-Maschine.
Prognose: Künstliche neuronale Netze und sogar künstliche Hirne werden schon in 20 Jahren mehr Transistoren konsumieren als konventionelle Rechner.
Die Frage ist, ob das Gehirn NUR rechnen kannt.
Durch die Anzahl der Transistoren allein wird eine KI noch lange keine starke KI.
Die chemischen Synapsen geben eine eindeutige Richtung für den Informationsfluss vor.
Funktionieren elektrische Synapsen in beiden Richtungen?
Chemische Synapsen funktionieren wie Sie richtig sagen nur in eine Richtung. Das ist einer der großen funktionellen Unterschiede zu dem elektrischen Synapsen. Diese sind in der Regel bidirektional, das heißt, die Information kann in beide Richtungen fließen. Es gibt aber auch elektrische Synapsen, welche wie chemische Synapsen den Informationsfluss in nur eine Richtung ermöglichen.
Der Quanta-Magazin-Artikel How Computationally Complex Is a Single Neuron? frägt danach wie gross ein künstliches neuronales Netz sein muss um ein einziges natürliches Neuron funktionell zu ersetzen. Resultat: man benötigt etwa 1000 künstliche Neuronen, die in 5 bis 8 Schichten angeordnet sind.
Diese 1000 künstlichen Neuronen wie sie in Deep Neural Nets (tiefen neuronalen Netzwerken) eingesetzt werden, verfügen lediglich über gewichtetete Zuleitungen und einen oder mehrere Ausgänge, wobei die Ausgänge ein Signal aussenden, wenn die Summe der gewichteten Zuleitungen einen Schwellwert übertrifft.
Letztlich kann man mit tiefen neuronalen Netzwerken beliebige Funktionen realisieren, auch die Funktion, die dem Verhalten eines natürlichen Neurons entspricht, allerdings benötigt man eventuell sehr viele davon, so viele, dass eine Simulation eines tiefen neuronalen Netzwerks bald einmal grosser Rechenleistungen bedarf.
“Elektrische Synapsen”
Bei mir stell sich immer wieder die Frage warum die Evolution so etwas entwickelt hat.
Wenn ich lese das elektrische Synapsen verzögerungsfrei arbeiten dann könnte das eine sehr schnelle Reaktion (Reflex) produzieren, was wiederum für das Tier überlebenswichtig wäre. Eine Bewertung-so wie bei den chemischen Synapsen -entfällt dann. So gesehen wären solche Synapsen vielleicht eine Art “Relikt” der evolutionären Entwicklung , haben doch diese Retzius Zellen auch Zugang zu solchen Botenstoffen wie Noradrenalin oder Gaba ?
@Golzower (Zitat): „ Wenn ich lese das elektrische Synapsen verzögerungsfrei arbeiten dann könnte das eine sehr schnelle Reaktion (Reflex) produzieren, was wiederum für das Tier überlebenswichtig wäre.“
Richtig: eine schnelle Reaktion kann überlebenswichtig sein. Doch es scheinen eben nicht Synapsen zu sein, die für das Hirn/Nervensystem zu langsam sind, sondern es ist die Weiterleitung von Nervenimpulsen an andere Nervenzellen, es ist die Nervenleitgeschwindigkeit: für unmyelierte Fasern beträgt sie 1 Meter pro Sekunde, für Fasern mit myelinierter Nervenscheide 100 Metern pro Sekunde.
1 Meter pro Sekunde ist ungeheuer langsam. Vor allem wenn man bedenkt, dass so ein Impuls etwa vom unteren Rückenmark zum Hirn geleitet werden muss. Das ist wohl der Grund, dass sich Myelinscheiden überhaupt ausgebildet haben.
Elektrische Synapsen sind keinesfalls ein Relikt der Evolution. Es ist richtig, dass die Schnelligkeit der Informationsübertragung bei elektrische Synapsen bei Fluchtreflexen vieler Tiere genutzt wird.
Das ist aber nicht die einzige Funktion elektrischer Synapsen. Sie übernehmen in unserem Gehirn sowie auch in den Nervensystemen anderer Tiere vielfältige Funktionen. Unter anderem regulieren sie die Erregbarkeit von Nervenzellen und damit deren Aktivität. Andererseits können elektrische Synapsen auch dafür sorgen, dass die neuronale Aktivität von ganzen Nervenzell-Netzwerken in unserem Gehirn synchronisiert wird (die synchrone Aktivität gewährleistet z. B. die synchrone Hormonausschüttung von Nervenzellen im Hypothalamus).
@Welzel
Wenn Strom fließt, dann entsteht ein Feld.
Wie messen Sie das Feld und wie wechselwirkt es mit Chemie und Transistor?
@ Georg Welzel
@ Martin Holzherr
Sehe es ähnlich wie Sie. Allerdings die wirklich extrem hohe Komplexität entsteht erst durch deren Zusammenwirken im extrem stark vernetzten System, besonders des Gehirns.
Man könnte es ungefähr so sehen, dass der „Neuronenkörper“ einem „Transistor“ entspricht, der dann „triggert“, wenn möglichst gleichzeitig, möglichst viele elektrische Ladungsträger über die Dendriten, allenfalls auch über „direkte“ andere Zugänge „einlangen“ (oder allenfalls auch „abgeleitet“ werden, um das „Triggern“ zu verhindern).
Die Zugänge und Abgänge (z.B. Dendriten, Axone) machen den „Neuronenkörper“ sozusagen zu einem „UND Gatter“ im Sinne von McCulloch.
Allerdings zu einem, ich würde es „qualifiziertes UND Gatter“ nennen, weil ausreichend „qualifiziert“ viele Ladungsträger zum Triggern erforderlich sind. Auch die elektrischen Parameter sind nicht so „stabil“, wie üblicher Weise in der Elektronik. Damit kann nicht von einem „exakten UND Gatter“ im Sinne der Boolschen Algebra gesprochen werden.
Genau dies begründet die exakte Informationsverarbeitung der Elektronik/Informatik, im Vergleich zur „launenhaften“ ( 3 Juristen 4 Rechtsmeinungen) Informationsverarbeitung biologischer Systeme.
Die Synapsen entsprechen, ganz anschaulich, Lötpunkten, allerdings mit einem „Übergangswiderstand“, der auf die „Ladungsträgerströme“ Einfluss nimmt. Außerdem gibt es, ähnlich wie in der Elektronik, auch Induktive und Kapazitive Funktionen, die letztlich „differenzierende bzw. integrierende Funktion“ (im Sinne der Mathematik) haben.
Es ergeben sich grundsätzlich „Information verknüpfende“ Effekte wie in Systemen der Elektronik, allerdings sind die Funktionen der Logik (Boolesche Algebra) erst dann erfüllt, wenn (statistisch) ausreichend viele (und starke) „Verknüpfungseffekte“ (sowohl in den Synapsen, als auch den Neuronen) auftreten. Kurz gesagt, wenn die jeweilige Information bestens gelernt wurde.
E. Kandel dürfte die synaptischen Funktionen und auch den Einfluss der Hebbschen Regel bei der Synapsenbildung erklärt haben.
Interessant wäre, die „Wirkungsstärke und die Wirkungsbedingungen“ der chem. oder elektrischen Synapsen zu klären. Ob, angenommen, z.B. elektrische Synapsen ganze „Bereiche“ (Cluster) stärker aktivieren/deaktivieren können, als die chemischen Synapsen? Dies könnte die Pharmaindustrie interessieren.
@ Georg Welzel
Vielleicht können Sie etwas mit meiner „schaltungstechnischen Sicht“ eines ehemaligen Elektronikers anfangen.
Ich würde meinen, die von Ihnen entdeckten elektrischen Synapsen könnten dazu beitragen, dass Neuronen sozusagen direkt (besonders schnell), „elektrisch gekoppelt“ werden können.
Dies wäre z.B. dann zweckmäßig, wenn eine besonders große Zahl von „parallelen“ Eingangssignalen, z.B. auch mehr als ein einzelnes Neuron überhaupt Dendriten hat, annähernd gleichzeitig ausgewertet werden müssen.
Eine „einfache Kaskadierung“ würde zu „zeitlichen Verwerfungen“ führen. Die vermutlich sehr schnellen elektrischen Synapsen könnten die Zellkörper auf annähernd gleichen elektrischen Pegel bringen, so dass die Neuronen bei entsprechenden Input, letztlich „gemeinsam triggern“.
Einfache Kaskadierungen („Hintereinanderschaltungen von Gattern“) können in anderen Fällen natürlich auch genutzt werden, z.B. um zeitliche Veränderungen bei „Mustern“ auswerten zu können.
Sind die „Ladungsübergänge“ in den elektrischen Synapsen „gerichtet“, so könnten bestimmte Neuronen „bevorzugt triggern“. Bedeutet, der jeweilige Input könnte sozusagen „bewertet“ werden.
Vielleicht entstehen auch die elektrischen Synapsen gemäß der Hebbschen Regel, also durch Lernprozesse.
@ Georg Welzel
Wenn diese, Ihre Aussage („herunterfahren“) bedeutet, dass das „Triggerniveau“ des Neurons verändert wird, im Sinne dass es z.B. „empfindlicher“ oder weniger „empfindlich“ auf Eingangsimpulse reagiert, so hätte das vermutlich starken Einfluss auf die Verarbeitung der Signale.
Bei einer „engen Koppelung“ mittels elektrischer Synapsen könnten „Cluster“ von Neuronenverbänden (die „zusammen“ einen bestimmten „Aufgabenbereich“ behandeln) sozusagen „selektiv“ gesteuert werden. Die elektrischen Synapsen würden sozusagen die „Clusterbildung“ (sozusagen eine gewisse „Zusammengehörigkeit“ bestimmter Verbände aus Neuronen) fördern.
Anschauliches, „an den Haaren herbeigezogenes“ Beispiel. Cluster 1 steuert „im Labor arbeiten“. Cluster 2 steuert „die Nahrungsaufnahme“.
Nach dem Essen ist das Cluster 2 sehr inaktiv weil nur sehr wenige Signale, die sozusagen „Hunger“ melden, aus der Sensorik eintreffen. Jetzt sollten die „Ladungspegel“ aller über elektrische Synapsen verknüpften Neurone sehr gering sein. Wenige „Störsignale“ setzen sich nicht durch.
Anders im Cluster 1. Es ist, von welcher Motivation, von welcher Sensorik auch immer „ausgelöst“, eine immer größer werdende „neuronale Aktivität“ vorhanden. Das System wird sozusagen immer mehr „hochgefahren“ und, auch wegen der „integrierenden Effekte“, verändern sich auch die Pegel für das Triggerniveau vieler Neuronen in wichtigen Clustern und das System wird immer „empfindlicher“ und „aktiver“.
Allmählich, so gegen Mittag, verändert sich die Signallage.
Im „Arbeitscluster 1“ werden die Inputsignale weniger, im „Hungercluster 2“ werden die Inputsignale zahlreicher. Möglicherweise kommen nicht nur über die chemischen Synapsen Signale, sondern auch von der „Gewohnheiten Steuerung“. Möglicherweise wird auch über die elektrischen Synapsen das Triggerniveau des ganzen Cluster so verändert, dass „Hungercluster 2“ immer aktiver wird, es sich gegenüber dem „Arbeitscluster 1“ durchsetzt.
Ich würde demnach vermuten, elektrische Synapsen nehmen zusätzlichen Einfluss auf die „Empfindlichkeitsregelung“ der „Cluster“ und es dürfte sogar so etwas wie einen „Vorrang“ bewirkende Steuerung geben, wenn die elektrischen Synapsen „gerichtet“ sind.