Simulationen und Explosionen
BLOG: Fischblog

Das Element Stickstoff hat eine ungewöhnliche Eigenschaft, die Chemikerinnen und Chemiker seit geraumer Zeit provoziert. Dieses Element bildet in Abwesenheit anderer Atomsorten nur das extrem stabile N2-Molekül – und das war’s. Von den benachbarten Elementen Kohlenstoff und Bor gibt es jeweils eine ganze Handvoll stabiler Formen, die das reine Element annehmen kann, und beim Sauerstoff existiert neben dem O2-Molekül immerhin das recht prominente Ozon.
Der Stickstoff tanzt aus der Reihe. Und so gibt es eine ganze Reihe Arbeitsgruppen, die auf der Suche nach alternativen Formen des elementaren Stickstoffs sind. Einierseits, weil so eine neue Stickstoffmodifikation sehr energiereich wäre und gleichzeitig keinerlei giftige Gase freisetzen würde, aber tatsächlich vor allem deswegen, weil niemand so recht glauben mag, dass es wirklich nur diese eine Variante geben soll.
Tatsächlich gibt es eine Reihe von Hinweisen, dass eine weitere reine Form des Stickstoffs nicht nur möglich ist, sondern vielleicht sogar schon heute in Reichweite der Chemiker liegt. Arbeitsgruppen haben auch schon N3 und N4 nachgewiesen – allerdings nur in in Form ganz, ganz weniger Moleküle, die einsam durchs Hochvakuum flitzen. Das zählt nicht wirklich.
Nicht viel besser steht es um das Ion N5+, das Forscher tatsächlich in sichtbaren Mengen hergestellt haben. Leider braucht man bei sowas zum Ausgleich ein negativ geladenes Gegenion, und das enthält immer auch andere Elemente als Stickstoff. Die Suche geht also weiter.
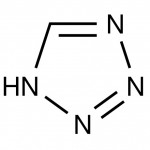
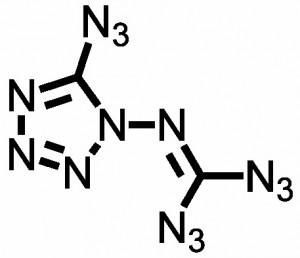
Zwei Wege können dabei zum Ziel führen. Bei der ersten Variante nimmt man ein stickstoffreiches Molekül und versucht, die restlichen Atome auch noch durch Stickstoff zu ersetzen – zum Beispiel bei Abkömmlinge des Tetrazols, das schon die recht stickstofflastige Summenformel N4CH2 hat. Diese Strategie ist nicht ganz ohne, denn je mehr Stickstoff so eine Verbindung enthält, desto instabiler wird sie. Was das in der Praxis bedeutet, hat Derek Lowe unter dem konsensfähigen Titel Things I Won’t Work With an einem hochexplosiven Beispiel erklärt.
Der zweite Weg kommt weitgehend ohne Explosionen aus und führt über Computersimulationen. Im Rechner entstehen dabei Kristallstrukturen, die aus allein aus Stickstoff bestehenden Molekülen zusammengesetzt sind. Ausgehend von der Schrödinger-Gleichung simuliert man die Elektronenverteilung in einem Molekül oder Kristall – und wo die Elektronen besonders dicht stehen, ist auch eine Bindung. Das Spiel nennt sich Dichtefunktionaltheorie.[1]
Das heißt, man lässt die virtuellen Elektronen im Potentialfeld der Atome herumwabern, bis sie sich im Zustand niedrigster Energie verteilt haben, und dann guckt man, welche Atome durch Bereiche hoher Elektronendichte aneinander gebunden sind. Diesen Weg ist auch ein Forscherteam gegangen, das kurz vor Weihnachten in Nature Chemistry ein ganz interessantes Ergebnis publizierte. Eigentlich ging es bei dem Experiment um die mögliche Kristallstruktur eines Körpers aus dem schon bekannten N4-Molekül. Es kam aber etwas Unerwartetes heraus.
Wenn man nämlich die N4-Moleküle in einen Kristall zwingt, sortieren sich die Bindungen um, so dass neue Moleküle entstehen. Das Ergebnis ist ein Molekülkristall aus reinem Stickstoff, allerdings besteht er aus den bislang unbekannten N8-Molekülen. Tatsächlich sogar aus zwei Varianten davon. N8 enthält eine Doppelbindung in der Mitte, an der die beiden Enden des Moleküls in zwei verschiedene Richtungen angesetzt werden können.
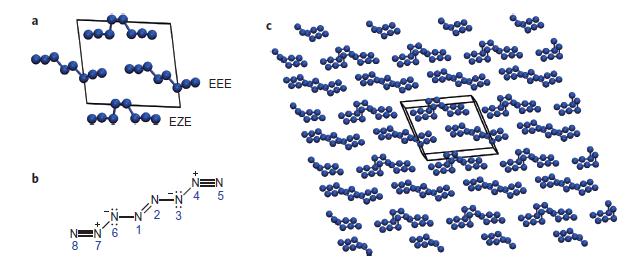
b) Die Strukturformel des N8 mit der Doppelbindung in E-Konfiguration.
c) Gesamtansicht der Kristallstruktur. Aus: Gerber et al, Nature Chemistry 10.1038/nchem.1818, 2013.
Der N8-Kristall reiht sich damit in eine wachsende Gemeinschaft theoretisch vorhergesagter Kristallstrukturen ein. Die anderen Kandidaten sind eine dreidimensional vernetzte Struktur, grob vergleichbar mit dem Diamantgitter beim Kohlenstoff, und ein Feststoff aus kettenförmigen Stickstoffpolymeren, der so ein bisschen kunststoffähnlich klingt. Keine dieser Strukturen, wohlgemerkt, hat es bisher in die Realität geschafft. Und das liegt nicht daran, dass es niemand versucht hätte.
Der neue Kristall als echter Molekülkristall säße quasi zwischen beiden bisher bekannten Strukturprinzipien. Und weil er in der Simulation aus den bereits experimentell nachgewiesenen N4-Molekülen entstand, gibt es nach Meinung der beteiligten Forscher sogar im Prinzip eine Synthesestrategie. Die basiert allerdings auf der Annahme, dass man irgendwie an größere Mengen N4 rankommt. Kommt man aber nicht. Das ist die erste schlechte Nachricht.
Die zweite schlechte Nachricht ist, dass der Kristall aus zwei unterschiedlichen Varianten des Moleküls bestehen soll. Sowas gibt es tatsächlich manchmal, aber es ist ziemlich rar. Meiner Meinung gibt es zwei Möglichkeiten: Entweder die neue Modifikation des Stickstoffs ist zufällig auch noch ein äußerst seltener Mischkristall, oder das Ganze ist ein Artefakt der Methode, das so in der Natur nicht existiert. Ich tippe in solchen Situationen gerne auf die zweite Möglichkeit, rein aus statistischen Gründen.
Punkt drei ist ein ganz praktisches Hindernis: Nach allem, was wir aus der organischen Chemie über stickstoffreiche Materialien wissen, würde der Kristall, so er sich denn herstellen ließe, seinen Erfindern schon beim Angucken um die Ohren fliegen.
.
.
.
[1] Für Fans: “plane-wave density functional theory (PW-DFT) with periodic boundary conditions and the Perdew– Burke–Ernzerhof (PBE) functional22 augmented by dispersion correction (PBE-D)”


Die nicht ganz leichte Synthese von nicht ganz stabilem polymerem Stickstoff:
http://www.mpg.de/821340/forschungsSchwerpunkt1?c=166500
Oh, danke für den spannenden Link. Den hatte ich gar nicht gefunden.