Antibiotika-Alternativen Teil II – Zellwandhydrolasen
BLOG: Fischblog

In diesem Teil meiner Serie über das Ende des Antibiotika-Zeitalters geht es um eine weit verbreitete Klasse von antibakteriellen Enzymen. Die Zellwandhydrolasen sind so spezifisch, vielseitig und wirksam, dass wir die klassischen Antibiotika möglicherweise schon bald nicht mehr vermissen werden – wenn es gelingt, das Potential dieser Stoffe auszuschöpfen.
(Hier geht’s zum ersten Teil der Serie: Bakteriophagen-Therapie)
Bei all dem Theater um Infektionen und Killerkeime kann man leicht mal vergessen, dass vielzellige Organismen ein ganzes Arsenal eigener Waffen haben, mit denen sie die allermeisten Bakterienattacken schon im Ansatz abwehren. Dazu gehört neben den klassischen Komponenten der Immunabwehr in Blut und Gewebe eine Reihe Bakterien tötender Biomoleküle, die oft die erste Verteidigungslinie bilden – zum Beispiel das zuerst aus Eiklar isolierte Lysozym. Dieses Protein gehört zu einer weit verbreiteten und vielfältigen Klasse antimikrobieller Wirkstoffe, die inzwischen als möglicher Antibiotika-Ersatz gehandelt wird: Zellwandhydrolasen.
Wie der Name schon sagt ist der hauptsächliche Wirkmechanismus der Zellwandhydrolasen ihre Fähigkeit, das als Murein bezeichnete Netzwerk aus Peptidoglycanen aufzulösen, das die für Bakterienzellen lebenswichtige Zellwand bildet. In den Bakterien herrscht ein osmotischer Druck von etwa 15 bis 25 Bar – ist die stabilisierende Zellwand zerstört, platzen die Zellen. Neben dem chemischen Angriff auf die verschiedenen Bindungen in der Zellwand haben sie einen zweiten, physikalischen Wirkmechanismus. Große Teile der Proteine sind positiv geladen und haben seifenähnliche Eigenschaften. Sie werden deswegen von den negativ geladenen Außenschichten der Zellmembran angezogen und dringen in sie ein. Dort stören sie die Membranfunktion und können so Bakterien entweder direkt töten oder das zelleigene Selbstmordprogramm auslösen.
Hydrolasen allüberall
Viele sehr unterschiedliche Organismen produzieren Zellwandhydrolasen, neben Säugetieren zum Beispiel Insekten, Pflanzen, Viren und sogar Bakterien selbst. Entsprechend vielfältig sind ihre Funktionen und Eigenschaften. Die erste wichtige Gruppe sind Substanzen wie Lysozym, die von Pflanzen und Tieren stammen und dort Bestandteil der Immunabwehr sind, zweitens bakterielle Enzyme, die Peptidoglycane abbauen, aber im Stoffwechsel der Bakterien auch andere Aufgaben erfüllen und drittens die schon im letzten Teil dieser Serie erwähnten Virolysine der Bakteriophagen.
Die Lysozyme haben im Allgemeinen ein recht breites Wirkungsspektrum und greifen neben diversen Bakterien auch einige Pilze und Viren an. Sie finden bereits in der Technik Anwendung, unter anderem in der Lebensmittelkonservierung (eine interessante Parallele zu Phagen). Menschen produzieren Lysozym im Speichel, Tränen, Urin und dem Schleim der Schleimhäute. Einige Säugetiere besitzen mehrere Lysozyme, Rinder und Schafe zum Beispiel derer zehn. Die Lysozyme sind im Hinblick auf ihre antibakterielle Aktivität angeht bereits recht gut erforscht, sie waren die ersten derartigen Enzyme, die man entdeckt hat. Entsprechend kommen sie bereits in verschiedenen Situationen zum Einsatz und man kennt auch eine Reihe Bakterienstämme, die bereits gegen diese Moleküle resistent geworden sind. Das sind natürlich relativ schlechte Aussichten für die Zukunft, zumal zusätzlich eine Reihe medizinisch bedeutsamer Pathogene gegen Lysozyme von Natur aus immun ist.
Bakterielle Zellwandhydrolasen bezeichnet man als Autolysine, meist membrangebundene Enzyme, die bei der Zellteilung, beim Aufbau der Zellwand oder auch an Infektionen beteiligt sind. Sie können beim Bakterium als Reaktion auf verschiedene Umweltreize auch das zelluläre Selbstmordprogramm auslösen. Als antibakterielle Wirkstoffe am interessantesten sind die Virolysine, die von lytischen Phagen stammen und dort in Zusammenarbeit mit dem Protein Holin neu gebildete Phagen aus der Zelle freisetzen. Diese zwischen etwa 25 und 40 kDa schweren Enzyme sind nicht membrangebunden und können einfach rekombinant hergestellt und dann als Biozid verwendet werden.
Virolysine – vielseitige Bakterienkiller
Wie spezifisch die Zellwandhydrolasen wirken, hängt vom Typ ab. Von den bakteriellen Autolysinen weiß man in dieser Hinsicht bisher sehr wenig, die klassischen Lysozyme wirken gegen eine große Bandbreite grampositiver Bakterien, sind gegen gramnegative Mikroben aber grundsätzlich unwirksam. Sie ähneln darin vielen Antibiotika. Eine Reihe medizinisch bedeutsamer Pathogene ist gegen Lysozyme außerdem schlicht immun. Diese Besonderheiten lassen es eher unwahrscheinlich erscheinen, dass diese Klasse von Zellwandhydrolasen eine Zukunft als Antibiotika-Ersatz hat.
Virolysine dagegen sind oft für einzelne Bakterienstämme oder Arten spezifisch und um gehen damit das Resistenzproblem der meisten Antibiotika. Der Grund für diese Spezifität ist ganz simpel: Bei Phagen soll das Virolysin die neu gebildeten Phagen freisetzen, und da wäre es blöd, wenn das Virolysin alle potentiellen Wirte in der Umgebung gleich mit umbrächte – deswegen binden diese Moleküle sehr fest an die Zellwand. Dieser Umstand hat einen weiteren erfreulichen Effekt. Es hat sich nämlich gezeigt, dass das Immunsystem sehr wohl Antikörper gegen Virolysine in der Blutbahn bildet – das macht aber keinen Unterschied: Die Bindung an die Zellwand ist so viel stärker dass die Antikörper das Protein einfach wieder freigeben.
Der Wirkmechanismus der Zellwandhydrolasen generell stellt zwei separate Anforderungen, die eine hohe Spezifität mindestens ermöglichen. Zum einem muss das Enzym an die Zellwand binden, um dort seine Wirkung zu entfalten[1], und zum Anderen braucht es natürlich die katalytisch aktive Domäne, um Bindungen zu spalten. Deswegen bestehen die allermeisten Virolysine aus zwei klar getrennten Domänen, die jeweils in vielen unterschiedlichen Varianten existieren. Die zellwandbindende Domäne bindet gezielt an ausgewählte funktionelle Gruppen in der Zellwand und sorgt so dafür, dass die Moleküle für jeweils andere Erreger spezifisch sind.
Diese Domäne trägt eine oder mehrere Domänen, die Bindungen in der Zellwand spalten. Es gibt drei Angriffsziele für diese katalytische Funktion: Einmal die Bindungen zwischen den Zuckereinheiten, dann die Quervernetzung zwischen den Peptidkomponenten der Zellwand und drittens die Bindung zwischen Zuckerkomponenten und Peptiden. Diese Vielfalt an Enzymkomponenten bietet interessante Möglichkeiten für künstliche antibakterielle Wirkstoffe – man kann die unterschiedlichen Domänen nämlich beliebig kombinieren, wie Untersuchungen zeigen.
Ermutigende Testergebnisse
Seit etwa Mitte der 90er arbeiten Forscher an Verfahren, Virolysine in vivo gegen Infektionen einzusetzen. Auch Virolysine wirken so wie’s aussieht nur gegen grampositive Bakterien, denn gramnegative Erreger besitzen eine zweite äußere Membran, die die Zellwand vor den Enzymen schützt. Dafür sind sie bemerkenswert wirksam gegen ihre Zielorganismen – eines der ersten getesteten Lysine tötete mehr als 99,9999 Prozent einer Kolonie von Streptococcus pyogenes binnen weniger Sekunden.
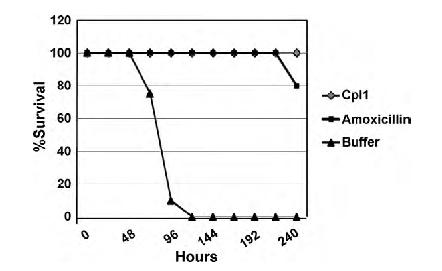
Überlebensraten von Mäusen nach Infektion mit Streptococcus Pneumoniae. Bei Behandlung mit dem Antibiotikum Amoxicillin oder der Zellwandhydrolase Cpl-1 überleben nahezu alle Tiere. Die unbehandelte Kontrollgruppe ist binnen fünf Tagen tot. Quelle: Fischetti, V. International Journal of Medical Microbiology 300 (2010) 357–362
Insbesondere haben Virolysine den großen Vorteil, dass sie bereits potentielle Infektionen durch bekannte pathogene Keime behandeln können, während sie noch symptomlos auf der menschlichen Schleimhaut siedeln. Dagegen kann man mit heutigen antimikrobiellen Verbindungen nichts unternehmen[2] – Virolysine jedoch wären spezifisch genug, um Resistenzen bei unbeteiligten Bakterien zu vermeiden. Insbesondere könnte man auf diese Weise in Krankenhäusern oder Pflegeheimen die Krankheitslast erheblich senken, indem man einfach die Patienten auf bekannte Pathogene screent und gegebenenfalls präventiv behandelt. Versuche an Tiermodellen dazu laufen bereits seit einigen Jahren.
In der Blutbahn haben Virolysine eine Halbwertzeit von etwa 15 bis 20 Minuten, bevor sie abgebaut werden. Allerdings wirken sie so extrem schnell, dass diese Zeitspanne für eine erfolgreiche Behandlung zum Beispiel einer Blutvergiftung locker ausreichen dürfte.[3] In Versuchen an mit S. pneumoniae infizierten Mäusen ließ jedenfalls eine Dosis Virolysin alle Tiere für 48 Stunden überleben, während von der Kontrollgruppe 80 Prozent starben. Das ist schon nicht schlecht, auch wenn Untersuchungen zeigen, dass die eine Dosis noch nicht reichte, um alle Bakterien zu töten. Man müsste ein solches Medikament deswegen wohl über einen längeren Zeitraum geben, oder durch chemische Modifikationen seine Lebensdauer deutlich erhöhen.
Vorteile und Nachteile
Ein wesentlicher Nachteil der Zellwandhydrolasen sind die derzeit sehr hohen Produktionskosten für diese Proteine. Forscher hoffen natürlich, dass die Kosten in Zukunft noch sinken werden, aber derzeit ist eine Therapie mit Virolysinen noch deutlich teurer als Antibiotika oder auch Phagen. Hinzu kommt der bereits angesprochene Umstand, dass sie gegen gramnegative Bakterien grundsätzlich wirkungslos sind. Dem gegenüber stehen mehrere Vorteile. Einerseits wirken sie völlig anders als bisherige Antibiotika, so dass es bei dieser Art der Therapie völlig uninteressant ist ob so ein Bakterium nun multiresistent ist oder nicht – Akronyme wie MRSA, ESBL oder NDM-1 könnte man damit wieder in die Fußnoten der Fachliteratur verbannen. Außerdem sind sie gut erforscht und erwiesenermaßen sicher und werden nicht vom Immunsystem abgefangen, und wegen ihrer hohen Wirksamkeit kann man sie in geringeren Mengen geben, was zumindest einen Teil der hohen Kosten wieder auffängt.
Auf jeden Fall sind die Ergebnisse bei einer ganzen Reihe von Infektionen sehr ermutigend. Im Tierversuch wirken spezifische Virolysine gegen Lungen- und Herzmuskelentzündung und sogar – via Infusion direkt in den Kopf – gegen Meningitis. Die bisher getesteten Virolysine sind relativ einfach rekombinant zu erzeugen und zu handhaben. Günstigerweise sind sie sogar bis 60 Grad hitzestabil, so dass Medikamente auf ihrer Basis womöglich ohne Kühlkette auskommen. Resistenzen gegen Virolysine gelten als extrem unwahrscheinlich – einerseits wegen ihrer Spezifität, unbeteiligte Bakterien sind nicht betroffen, andererseits hat sich auch in Versuchen gezeigt (pdf, Resistenztests auf S. 885 rechts unten), dass sich Resistenzen auch dann nur schwer bilden, wenn man es drauf anlegt – und selbst wenn sie auftreten sollten, wechselt man einfach das Enzym. Es gibt geschätzte 1031 Phagen auf der Welt.
.
.
.
[1] Es ist nicht ganz klar warum das so ist, aber frei schwimmende katalytische Domänen sind deutlich weniger aktiv. Forscher haben gezeigt, dass katalytische und bindende Domäne miteinander interagieren, es ist also möglich, dass erst die Bindung an die Zellwand das reaktive Zentrum “scharf” macht.
[2] Einerseits weil man so Resistenzen fördert, andererseits aber auch, weil klassische Antibiotika gleich die gesamte Schleimhautflora abtöten und so gefährlichen Erregern erst recht den Weg freiräumen.
[3] Mit dem kleinen Haken dass in schweren Fällen die massenhaft sterbenden Bakterien alle gleichzeitig ihre Endotoxine freisetzen, so dass der Patient wohl trotzdem tot wäre.


Preisfrage
“Ein wesentlicher Nachteil der Zellwandhydrolasen sind die derzeit sehr hohen Produktionskosten für diese Proteine. Forscher hoffen natürlich, dass die Kosten in Zukunft noch sinken werden, aber derzeit ist eine Therapie mit Virolysinen noch deutlich teurer als Antibiotika oder auch Phagen.”
Gemessen an den aktuellen Produktionskosten, kannst du bitte ein Beispiel geben, wieviel Prozent teurer oder in absoluten Zahlen wieviel man zb. für die Behandlung einer Maus zahlen würde für Antibiotika, Phagen und Virolysinen?
So das man den Unterschied etwas klarer sieht?
Vielen Dank. 🙂
Gute Frage…
Ich hatte mal angefangen da konkret zu recherchieren, aber gerade bei den Lysinen ist das Problem dass alle Kosten die ich da finde quasi inklusive Labortiere und Doktoranden sind (die Doktoranden sind allerdings deutlich billiger). Deswegen ist das alles nicht wirklich vergleichbar.
In dieser Studie (von 1994) kostete ne Behandlung mit Vancomycin alles inclusive etwa 300 Dollar pro Patient, davon macht das Antibiotikum selbst etwa die Hälfte aus.
Eine Phagentherapie kostet dem Vernehmen nach da, wo sie praktiziert wird, etwa das zehn- bis zwanzigfache, also einige tausend Dollar. Die Frage ist natürlich, wie sich der Preis zusammensetzt und wie sich die Kosten bei breiter Anwendung entwickeln würden.