Geheime Zeichen an der Wand: Die Rolle von Laminin Alpha-4 bei der Multiplen Sklerose
BLOG: Die Sankore Schriften

Bei der Multiplen Sklerose (MS) kommt es zu einer fehlgeleiteten Immunreaktion. Zytotoxische T-Zellen des Immunsystems sogenannte CD8-Zellen attackieren Nervenzellen von Hirn und Rückenmark wie einen Krankheitserreger. Dabei wird das weiße fettreiche Myelin, das die langen Axone der Neurone umhüllt, zerstört. Neben der Myelinschicht der Axone greifen die T-Zellen auch den Zellkörper der Nervenzelle an.
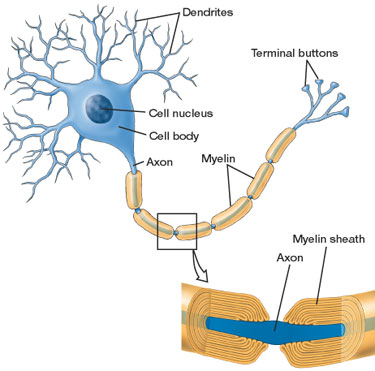
Abb.1: Eine Nervenzelle des zentralen Nervensystems mit myelinisiertem Axon oben: Gesamtansicht der Nervenzelle unten: Detailansicht des myelinisierten Axons
Je nachdem, wo im Hirn oder Rückenmark und in welchem Ausmaß diese Schädigungen vorliegen, können verschiedene Symptome auftreten: Sehverlust und Sprachschwierigkeiten gehören dazu, aber auch Zittern, Taubheitsgefühl oder eine Einschränkung der Bewegung.
Das Angriffsziel der CD8-Zellen wird durch ein spezifisches Antigen, das auf der Oberfläche der Nervenzelle präsentiert wird, als „schädlich“ oder „infiziert“ markiert. Bei MS, einer Autoimmunkrankheit, handelt es sich dabei um körpereigene Antigene sogenannte Autoantigene.
Contactin-2 ein Protein, ist ein Autoantigen der MS das sich unglücklicherweise sowohl im Myelin als auch im Nervenzellkörper befindet [1]. Warum wird Contactin-2 zum Autoantigen? Kann jedes Protein zum Autoantigen werden oder sind bestimmte Proteine durch bestimmte biochemische Charakteristika prädisponiert? Wenn ja – Welche Charakteristika sind das? Spezifische Sequenzen in der Primärstruktur? Bestimmte Motive der Proteinfaltung? Bestimmte Arten der Glykolysierung oder Phosphorylisierung? Fragen, auf die wir hoffentlich bald Antwort bekommen. Mit etwas Glück ergibt sich dann ein Ansatz, der uns zeigt, wie wir verhindern können, dass Contactin-2 zum Autoantigen wird. Ich könnte mir z. B. allgemein vorstellen – nicht speziell für Contactin-2, das durch eine falsche Glykolysierung, daher dem Anheften von Zuckern an die falsche Stelle im Protein oder von falschen Zuckern an die richtige Stelle im Protein eine Kaskade ausgelöst wird, die zum Autoantigen führt. Natürlich kommt dann die Frage, was denn nun zur falschen Glykolisierung führt.
Schon wenige Sekunden nach ihrem Angriff legen die T-Zellen die Neurone durch die Freisetzung von Perforin und Granzym B elektrisch still [2]. Perforin wird in die Zellmembran der Nervenzelle eingebaut und bildet dort eine Pore, durch das Granzym B, eine Serinprotease, in die Zelle eindringt. Granzym B aktiviert dann die Caspasen, die den programmierten Zelltod (die Apoptose) auslösen. Zusätzlich bewirkt Perforin einen Anstieg von Kalzium-Ionen in der Nervenzelle und verändert so ihre elektrischen Eigenschaften.
Wie dringen die zytotoxischen T-Zellen in das zentrale Nervensystem (ZNS) ein? Sie müssen dafür ja die Bluthirnschranke überwinden.
Alle Blutgefäße im Säugetierkörper sind von Endothelzellen ausgekleidet. Diese schließen aber nicht lückenlos und betreiben außerdem einen intensiven Stoff- und Gasaustausch mit dem umgebenden Gewebe. Anders im Zentralnervensystem: Hier liegen die Endothelzellen der Gefäße dicht an dicht und sind mit Tight-junctions verklebt, außerdem exprimieren sie spezifische Transportmoleküle. Es gibt also kein einfaches Durchkommen.
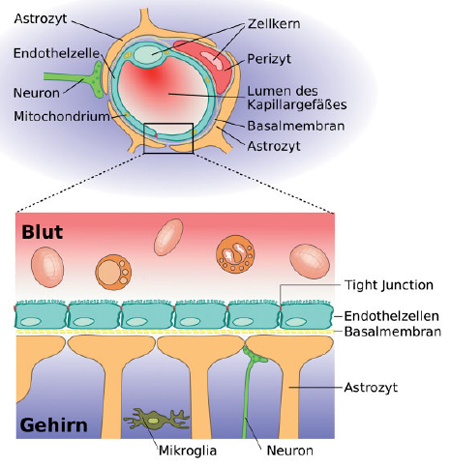
Abb.2: Die Bluthirnschranke im ZNS oben: Querschnitt durch eine Blutkapillare des Gehirns unten: Detailansicht
Die Barrierenbildung der Endothelzellen kommt im Wechselspiel mit den Pericyten des ZNS zustande. Pericyten sind Bindegewebszellen, die die Blutkapillaren von außen umgeben und die Endothelzellen der Blutgefäße bedecken (siehe die Querschnittsansicht in der Abbildung 2). Die Bedeckung der Kapillarepithelzellen mit Pericyten ist entscheidend für die Durchlässigkeit der Blutgefäße – und zwar nicht, weil Pericyten den dichten Zusammenschluss der Epithelzellen auslösen, sondern weil sie die Expression durchlässigkeitsfördernder Gene verhindern [3]. Auch histologische Befunde unterstreichen die Bedeutung der Pericyten bei der Bildung der Bluthirnschranke: Blutgefäße des Zentralnervensystems haben die höchste Pericyten-Bedeckung von allen Blutgefäßen. Je dichter sie mit Pericyten bedeckt sind, umsoweniger permeabel sind sie.
Doch zurück zu den zytotoxischen T-Zellen bei der MS.
Wie Einbrecher tasten sie sich nun an der Mauer entlang um die Geheimtür zu finden durch die sie auf das Grundstück gelangen. Die Einbrecher kennen die geheimen Zeichen, die den Ort an dem sich die Geheimtür befindet, markieren. Das müssen sie, denn normalerweise stellen diese T-Zellen eine Art Gesundheitspolizei des Körpers dar. Sie zirkulieren ständig im Blutstrom unseres Körpers und patrouillieren durch die Gefäße aller Organe. Wo immer in einem Gewebe durch eine Infektion eine lokale Entzündung auftritt, wandern sie an diesen Ort, um dort die Entzündungsreaktion voranzutreiben. Das heißt: Wenn wir verstehen, wie und wo genau die T-Zellen die Bluthirnschranke überwinden, können wir sie aussperren und so die zerstörerischen Prozesse vermeiden, die dem Eindringen in das zentrale Nervensystems folgen.
T-Zellen treiben passiv mit dem Blutstrom, kommunizieren aber ständig mit der Blutgefäßwand, um abzufragen, ob dort relevante Signale gezeigt werden. Ingo Bartholomäus und Naoto Kawakami vom Max-Planck-Instituts für Neurobiologie in Martinsried konnten live beobachten, dass die T-Zellen wenn sie die Blutgefäße des Nervensytems erreichten sich völlig anders verhielten [4]. Immer häufiger begannen sich die Zellen an den Gefäßwänden festzusetzen. “Richtig spannend wurde es dann, als wir sahen, dass die Zellen kriechen – das war ein bisher gänzlich unbekanntes Verhalten für T-Zellen”, berichtet Ingo Bartholomäus von seinen Beobachtungen. Kriechen beschreibt hier eine aktive Bewegung der Zellen, die vor allem gegen den Blutstrom verläuft. Die Forscher beobachteten, wie die T-Zellen für mehrere Minuten bis Stunden an den Gefäßwänden entlangwanderten und oder ihre Kreise zogen . Am Ende dieser Suchbewegung wurden die Zellen entweder wieder vom Blutstrom mitgerissen oder sie zwängen sich durch die Gefäßwand. Ist das der Fall, durchwandern sie zunächst die Endothelzellschicht und stoßen dann auf die nächste Barriere, die Basalmembran (siehe Detailansicht in der Abbildung). Um diese Hürde auf ihrem Weg zu den Entzündungsherden zu überwinden, suchen die T-Zellen nach einer geeigneten Stelle in der Basalmembran, die durch eine bestimmte Mischung von Proteinen gekennzeichnet ist. T-Zellen orientieren sich an einem bestimmten Proteintyp in der Basalmembran, den Lamininen. Sie verlassen genau dort das Blutgefäß im Gehirn, wo das Laminin alpha-4 in der Basalmembran steckt [5].
Damit haben wir nun einen Ansatzpunkt, um das Fortschreiten der Multiplen Sklerose durch Sperrung des Zustroms von T-Zellen zielgenau zu blockieren. Dafür müsste es uns gelingen sehr spezifisch das Laminin alpha-4 zu blockieren, das sich in der Basalmembarn des zentralen Nervensystems befindet.
Weiterführende Literatur
Bildnachweis
Abb.1: Eine Nervenzelle des zentralen Nervensystems mit myelinisiertem Axon
Public Books
Psychology An Introduction
Chapter 2 : The Biological Basis of Behavior
© 1995-2002 by Prentice-Hall, Inc. A Pearson Company
Abb.2: Die Bluthirnschranke im zentralen Nervensystem
Quelle: Inge Kronberg (2011) Bluthirnschranke: Bis hierher und nicht weiter Biol. Unserer Zeit, (41), 90-91.
Autoren der Abbildung: Armin Kübelbeck und Patrick J. Lynch.

