Wie man isotopenmarkierte Peptide in Bakterien herstellt
BLOG: Detritus

Wie ich anderswo schon beschrieben habe, arbeite ich mit menschlichen HLA-Proteinen, die ein Teil des Immunsystems sind, und deren Aufgabe es ist, etwa Virenbefall der Zelle zu signalisieren, deren Fehlfunktion aber auch mit Autoimmunkrankheiten in Verbindung gebracht wird. Es gibt einige solcher HLA-Proteine, die sich nur durch eine einzige Aminosäure unterscheiden, aber mit unterschiedlichen Krankheitsbildern assoziiert werden. So sind etwa die beiden Proteine HLA-B2709 und HLA-B2705 fast identisch, sind aber unterschiedlich mit der rheumatischen Krankheit Morbus Bechterew assoziiert. Träger des Gens für HLA-B2705 erkranken öfter an Morbus Bechterew, bei der sich Gelenke entzünden und zunehmend verknöchern.
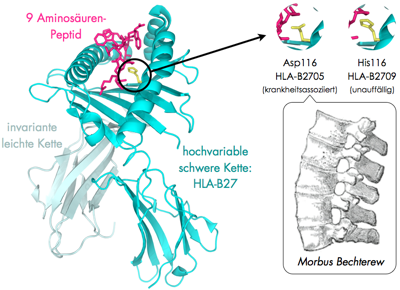
Links: Der Proteinkomplex in einer Cartoon-Darstellung, rechts hervorgehoben der Unterschied, der in nur einier einzigen Aminosäure besteht. (Bilder: eigene Arbeit, Wirbelsäule nach „Gray’s Anatomy“)
Für die NMR muss man seine Proteine markieren
Für die kernmagnetische Resonanz-Spektroskopie (NMR), mit der man Moleküle auf atomarer Ebene betrachten kann, benötigt man nun Proteine mit „magnetischen“ Atomkernen. Das Leben besteht vor allem aus den drei Elementen Wasserstoff, Kohlenstoff und Stickstoff, die den Hauptbestandteil der Biomasse bereitstellen. Bei Wasserstoffatomen hat man Glück, denn hier ist die natürlicherweise häufigste Atomsorte (Isotop) mit der Masse von 1 (1H) auch diejenige mit einem magnetischen Atomkern.
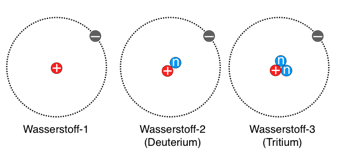
Die natürlichen Isotope (Atomsorten) des Wasserstoffs, die sich durch die Zahl der Neutronen im Kern unterscheiden. Grau: negativ geladene Elektronen in der Hülle; rot: positiv geladene Protonen, sowie blau: ungeladenen Neutronen im Kern des Atoms.
Bei Kohlenstoff ist es anders: ganze 98,9% der natürlich vorkommenden Isotope sind das quasi nutzlose Isotop 12C, wir brauchen aber das schwerere 13C. Bei Stickstoff ist es noch schlimmer, denn hier bestehen nur etwa 0,4% der natürlichen Stickstoffatome aus dem Isotop 15N, der Rest ist 14N.
Um trotzdem messen zu könenn, behilft sich in der Regel damit, den Bakterien, die das Protein herstellen, die entsprechenden Atomsorten zuzufüttern, damit sie diese einbauen. Das erfordert mitunter Einiges an Fingerspitzengefühl, insbesondere, wenn man den „schweren Wasserstoff“ Deuterium (2H) einbauen will: Dieses Atom ist schließlich doppelt so schwer, wie das reguläre 1H und das nehmen einem die Zellen mitunter sehr übel. Bei Kohlenstoff und Stickstoff ist der Unterschied längst nicht so gravierend.
Die Herstellung von Peptiden
Wenn die Proteine nur kurz genug sind, kann man sie auch technisch-synthetisch herstellen. Wenn man keine besonderen Wünsche hinsichtlich der Isotopen hat, ist das eine schnelle und kostenoptimale Möglichkeit, riesige Mengen von kurzen Peptiden herzustellen. Allerdings stößt man bei Isotopen-Sonderwünschen schnell an seine finanziellen Grenzen, denn die isotopenmarkierten Aminosäuren mit entsprechenden Schutzgruppen sind extrem teuer.
Alternativ kann man wieder auf die Biosynthese, also die Herstellung in gentechnisch manipulierten Bakterien, zurückgreifen, wieder mit Zufütterung der gewünschten Atomsorte. Dafür ist es aber notwendig, sie als Anhängsel an einem großen Protein herstellen zu lassen, denn die Bakterienzelle zerlegt kurze, unstrukturierte Peptidschnipsel in kürzester Zeit in seine Aminosäurebestandteile zurück. Ein System, das bereits in den 1990er Jahren etabliert wurde, macht sich das kleine Protein Ubiquitin zunutze, das natürlicherweise nicht in Bakterien vorkommt. Ubiquitin wird in Ketten an andere Proteine angehängt, und ein äußerst genau arbeitendes Enzym kann die Einzelglieder der Kette abspalten.
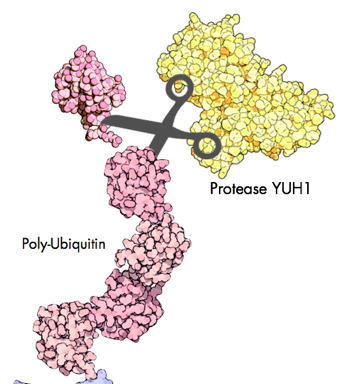
Das Enzym YUH1 zerschnippelt Ubiquitin-Ketten zu Einzel-Ubiquitinen.
Das Ganze kann man sich zunutze machen, indem man an das Ende des Ubiquitins „einfach“ sein Peptid dranhängt, das Spaltenzym getrennt herstellt, alles in einen Topf wirft und dabei zusieht, wie das Peptid vom Ende des Ubiquitins abgeschnitten wird.
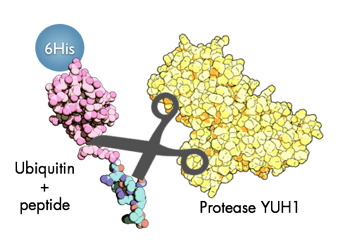
Das Enzym schneidet anstandslos kurze Peptide vom Ende des Ubiquitins ab. Das „6-His“ steht für ein Anhängsel, das bei der Aufreinigung des Proteins hilft, das His-Tag. Hier ist es am entgegengesetzten Ende des Ubiqutins angebracht.
Am Ende hat man dann sein Peptid, ganz wunderbar mit den gewünschten Isotopen, zu einem Bruchteil des Preises. Dann besteht die Kunst nur noch darin, aus dem Reaktionsgemisch, in dem natürlich noch das Spaltenzym und das abgespaltene Protein herumschwimmen, das Peptid zu isolieren.
Hat man auch das gemeistert, kann man mit dem hochreinen Peptid die ganz oben abgebildeten Komplexe herstellen (auch nochmal ein Kapitel für sich) und daran Strukturforschung betreiben.
Literatur
Kohno, T., Kusunoki, H., Sato, K., & Wakamatsu, K. (1998). A new general method for the biosynthesis of stable isotope-enriched peptides using a decahistidine-tagged ubiquitin fusion system: an application to the production of mastoparan-X uniformly enriched with 15N and 15N/13C. Journal of biomolecular NMR, 12(1), 109–121.



Niemandem ist aufgefallen, dass ich Sauerstoff als „Element des Lebens“ völlig unterschlagen habe … Spricht gegen die Qualität des Artikels 😀